
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Подгруппа железа
|
|
|
|
Т 14 Л 19 d-Элементы VIII группы периодической системы
В VIII группу входят девять d-элементов, которые составляют три подгруппы — подгруппу железа (железо Fе рутений Ru, осмий Оs), подгруппу кобальта (кобальт Со, родий Rh, иридий Ir) и подгруппу никеля (никель Ni, палладий Рd, платина Рt).
По мере заполнения (n—1) d -орбиталей вторым электроном усиливается сходство соседних d -элементов по периоду. Так, никель проявляет большое сходство как с Со и Fе, так и с Сu, Кроме того, вследствие лантаноидного сжатия особая близость свойств наблюдается у диад Ru—Оs, Rh—Ir и Рd—Рt. Поэтому эти элементы 5-го и 6-го периодов часто объединяют в семейство так называемых платиновых металлов.
Железо Fе, рутений Ru и осмий Оs — каждый в своем периоде являются первыми d -элементами, у которых начинается заполнение d -орбиталей предвнешнего слоя вторым электроном. Поэтому они являются родоначальниками вторых подсемейств d-элементов.

Для железа наиболее характерны степени окисления +2 и +3, известны также производные железа, в которых его степень окисления равна —2, 0, +4 и +6. Наиболее устойчивы соединения Ru (IV) и Оs (VIII).
Для элементов подгруппы железа характерны координационные числа 6 и 4.
Железо — один из наиболее распространенных элементов в земной коре. Оно входит в состав многочисленных минералов, образующих скопления железных руд. Главнейшие из них: бурые железняки (основной минерал гидрогетит НFеО2×nН2О), красные железняки (основной минерал гематит Fе2О3), магнитные железняки (основной минерал магнетит Fе3О4), сидеритовые руды (основной минерал сидерит FеСО3) и др. Железо содержится в природных водах. Изредка встречается самородное железо космического (метеорного) или земного происхождения. Метеорное железо обычно содержит значительные примеси кобальта и никеля. Железо — составная часть гемоглобина.
Рутений и осмий сопутствуют платине и палладию в полиметаллических рудах, а также встречаются в виде самородных сплавов с иридием и платиной.
Простые вещества. В виде простых веществ Fе и Ru — серебристо-белые металлы, Оs — голубовато-белый металл. Осмий — самый тяжелый из всех металлов, очень твердый и поддается растиранию в порошок.
 В соответствии с усилением вклада ковалентной связи (за счет 3d-, 4d- и 5d электронов соответственно) в ряду Fе—Ru—Оs теплота сублимации, температуры плавления и кипения заметно возрастают.
В соответствии с усилением вклада ковалентной связи (за счет 3d-, 4d- и 5d электронов соответственно) в ряду Fе—Ru—Оs теплота сублимации, температуры плавления и кипения заметно возрастают.
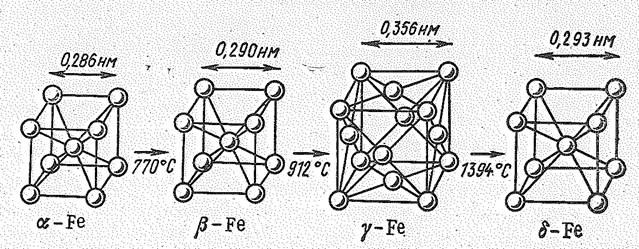 Рис. 1. Полиморфное превращение железа.
Рис. 1. Полиморфное превращение железа.
Железо имеет четыре модификации (рис. 1). До 770°С устойчиво a-Ее с объемноцентрированной кубической решеткой и ферромагнитными свойствами, При 770°С a-Fе переходит в b-Fе; у него исчезают ферромагнитные свойства и железо становится парамагнитным, но кристаллическая структура его существенно не изменяется. При 912°С происходит полиморфное превращение, при котором изменяется структура кристалла: из объемноцентрированной переходит в гранецентрированную кубическую структуру g-Fе, а металл остается парамагнитным. При 1394°С происходит новый полиморфный переход я образуется d-Fе с объемноцентрированной кубической решеткой, которое существует вплоть до температуры плавления железа (1539°С).
Рутений и осмий имеют гексагональную кристаллическую решетку.
Железо — металл средней химической активности. В отсутствие влаги в обычных условиях пассивируется, но во влажном воздухе легко окисляется и покрывается ржавчиной. При нагревании (в особенности в мелкораздробленном состоянии) взаимодействует почти со всеми неметаллами. При этом в зависимости от условий и активности неметалла образуются твердые растворы (с С, Si, N, В, Р, Н), металлоподобны (Fе3С, Fе3Si, Fе3Р, Fе4N, Fе2N) или соли и солеподобные (FеF3, FеСl3, FеS) соединения. Окисление железа кислородом приводит к образованию оксидов нестехиометрического состава.
Железо легко взаимодействует с разбавленными кислотами в отсутствие кислорода образуя производные Fе(II): Fе2+ + 2е = Fе, Е0298 = —0,44 В. В концентрированных НNO3 и Н2SO4 пассивируется. В обычных условиях в щелочах железо не растворяется. Рутений и осмий (как и простые вещества большинства других d -элементов 5-го и 6-го периодов) химически малоактивны. В обычных условиях на компактные металлы не действуют даже наиболее активные неметаллы. Но мелкораздробленный осмий постепенно окисляется кислородом и концентрированной НNO3 до OsO4. Рутений медленно окисляется кислородом лишь выше 450 °С, давая летучий RuO4.
В виде компактных металлов рутений и в меньшей степени осмий устойчивы по отношению с кислотам и их смесям, но разрушаются в растворах гипохлоритов и при сплавлении со щелочами в присутствии окислителей, т. е. в условиях, способствующих образованию оксоанионов с высокими степенями окисления d -элемента:
Э0 + 3КСlО + 2NаОН = Nа2Э+6О4 + 3КСl +Н2О
Благодаря высокой твердости и высокой коррозионной устойчивости осмий и его сплавы с рутением (и иридием) применяются для изготовления ответственных деталей точных измерительных приборов, а также наконечников перьев авторучек. Осмий, рутений и железо — высокоэффективные катализаторы синтеза аммиака. Рутений и осмий — эффективные катализаторы процессов гидрогенизации; синтеза углеводородов с длинными цепями.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2778; Нарушение авторских прав?; Мы поможем в написании вашей работы!