
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения лантаноидов
|
|
|
|
Соединения Э (III). Для лантаноидов в степени окисления +3 известны многочисленные бинарные соединения (Э2О3, ЭНаl3, Э2S3. ЭN, ЭH3) и разнообразные соли. Энтальпии и энергии Гиббса образования однотипных соединений лантаноидов близки; например, DGof их кристаллических трихлоридов имеют следующие значения (кДж/моль):
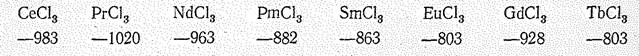 Низкие значения энтальпии атомизации тригалогенидов европия (4 f 76 s 2) и иттербия (4f146 s 2) указывают на увеличение стабильности электронной конфигурации 4 f 14 (полное заполнение 4 f -уровня) и 4 f 7 (наибольшее число непарных 4 f -электронов). Это находит квантовомеханическое объяснение. Достаточно высокую энергию связей обеспечивают 6 s - и 5 d -электроны. Привлечение же для образования связей глубже расположенных 4 f -электронов вызывает снижение энтальпии атомизации. Особенно это сказывается в случае наиболее стабильных конфигураций f 7 и f 14.
Низкие значения энтальпии атомизации тригалогенидов европия (4 f 76 s 2) и иттербия (4f146 s 2) указывают на увеличение стабильности электронной конфигурации 4 f 14 (полное заполнение 4 f -уровня) и 4 f 7 (наибольшее число непарных 4 f -электронов). Это находит квантовомеханическое объяснение. Достаточно высокую энергию связей обеспечивают 6 s - и 5 d -электроны. Привлечение же для образования связей глубже расположенных 4 f -электронов вызывает снижение энтальпии атомизации. Особенно это сказывается в случае наиболее стабильных конфигураций f 7 и f 14.
В отличие от d -элементов координационные числа f -элементов могут превышать 9 и достигать 10—14, что объясняют участием в образовании связей f -орбиталей. Высокие координационные числа более характерны для атомов f -элементов начала семейства, для завершающих семейство элементов наиболее типична октаэдрическая структура комплексов.
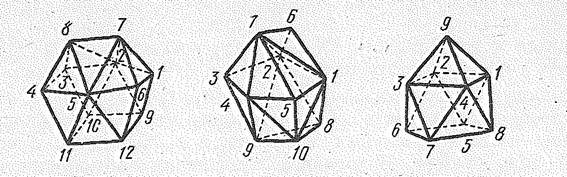
Рис. 2. Некоторые типы полиэдров, отвечающие характерным координационным числам лантаноидов (III)
Окраска ионов Э3+ закоиомерно изменяется в соответствии с большей или меньшей стабилизацией 4 f -состояния. Так, ионы с электронной конфигурацией 4 f 0, 4 f 7 и 4 f 14, а также 4 f 1 и 4 f 13 бесцветны, остальные имеют более или менее интенсивную окраску. Окраска ионов Э3+ обусловлена f — f -переходом. Поскольку 4/-электроны эффективно экранированы от внешних воздействий 5 s 2 и 5 р 6-подслоями, окраска ионов не зависит от природы их координационного окружения.
Оксиды лантаноидов Э2О3 характеризуются высокими энтальпиями и энергиями Гиббса образования (DGof = —1600 кДж/моль) и тугоплавкостью (Тпл. порядка 2000 оС). Оксиды — основные соединения. В воде они практически не растворяются, но взаимодействуют с ней, образуя гидроксиды и выделяя тепло. Оксиды Э2О3 хорошо растворяются в НСl и НNO3, но, будучи прокалены, как и Аl2O3, теряют химическую активность. Со щелочами не взаимодействуют. Окраска оксидов определяется электронной конфигурацией иона Э3+.
Гидроксиды Э(ОН)3 получают в виде аморфных осадков по обменным реакциям. Согласно с уменьшением радиусов в ряду Се3+—Lu3+ несколько ослабляется основной характер гидроксидов, падает их термическая устойчивость и уменьшается растворимость. Так, произведение растворимости Lа(ОН)3 ПР = 1,0×10-19, Се(ОН)3 и Рr(ОН)3 ПР = 10-20 и далее уменьшается, достигая у Lu(ОН)3 ПР = 2,5×10-24.
Из солей лантаноидов (III) в воде растворимы хлориды ЭСl3, нитраты Э(NО3)3, сульфаты Э2(SO4)3, трудно растворимы фториды ЭF, карбонаты Э2(СО3)3, фосфаты ЭРО4.
Кристаллогидраты лантаноидов (III) имеют переменное количество молекул воды, например Э(NО3)3×6Н2O, ЭВr3×6Н2O, Э2(SО4)3×8Н2О, Nd(ВiО3)3×9Н2O. Окраска аквокомплексов зависит от электронной конфигурации нона Э3+.
Для лантаноидов (III) довольно типичны двойные соли, например 3Mg(NО3)2×2Э(NО3)3×24Н2O, M1+2Э(NО3)5×4Н2O, 3Nа2SО4×Э2(SО4)3×12Н2O. Ион [Се(NО3)6]3- имеет форму двенадцативершинника (по атомам О), ион iСе(NО3)5]2- — форму десятивершинника, а ион [Nd(OН2)9]3- — девятивершинника. Весьма разнообразны комплексы лантаноидов с лигандами хелатного типа.
Для лантаноидов (III) известны различные комплексы с органическими лигандами, которые играют большую роль при разделении РЗЭ.
Гидриды лантаноидов образуются при взаимодействии простых веществ, которое протекает при нагревании (300—400 оС), достаточно активно. Все лантаноиды образуют гидриды состава ЭН2, а также, за исключением европия и иттербия, соединения, приближающиеся к составу ЭН3. Особенности поведения Еu и Yb, по-видимому, связаны с устойчивостью 4 f 7- и 4 f 14-конфигураций.
Гидриды ЭH2 построены по типу флюорита и имеют солеобразный характер. Они в большей мере напоминают ионные гидриды щелочноземельных металлов, а с гидридами d -элементов имеют мало общего. Водородные соединения лантаноидов — химически весьма активные вещества, очень энергично взаимодействуют с водой, кислородом, галогенами и другими окислителями. Особо реакционноспособны соединения типа ЭН3.
Благодаря высокой температуре плавления оксиды, сульфиды, нитриды и карбиды лантаноидов используются для изготовления огнеупорной керамики. Разнообразно применение соединений лантаноидов в производстве специальных стекол.
Соединения Э (IV). Как уже указывалось, степень окисления +4 характерна для церия и может проявляться у тербия и празеодима. У церия (IV) выделены оксид СеO2 (светло-желтый), фторид СеF4 (белый), гидроксид Се(НО)2 (желтый), немногочисленные соли Се(СlO4)4, Се(SO4)2. Диоксид СеO2 образуется при непосредственном взаимодействии простых веществ или при термическом разложении некоторых солей церия (III) в присутствии кислорода. Он тугоплавок (Тпл. 2500 °С). Прокаленный СеО2 химически довольно инертен, не взаимодействует с кислотами и щелочами.
Гидроксид Се(ОН)4 получается по обменной реакции в водном растворе в виде студенистого осадка переменного состава СеО2×nН2О. В отличие от Се(ОН)3 он проявляет амфотерные признаки. При растворении СеО2×nН2О в кислотах образуются растворы оранжевого цвета, обусловливаемого окраской аквокомплексов [Се(ОН2)n]4+. Химия водных растворов Се(IV) аналогична химии Zr (IV) и Hf (IV). За немногим исключением соли церия (IV) неустойчивы, в воде сильно гидролизуются. Более устойчивы двойные соли церия (IV). Так, из азотнокислого раствора кристаллизуется соль (NН4)2[Се(NО3)6]×2Н2O (оранжево-красного цвета). Ион [Се(NО3)6]2- имеет форму икосаэдра, (Се4+ окружен 12 атомами О), т. е. NO3--ион выступает. в качестве дидентатного лиганда.
При сплавлении СеО2×nH2O со щелочью, а СеF4 с КF образуются соответственно оксо- и фтороцераты (IV):
2NaOH + СеO2 = Nа2СеО3 + Н2O
2КF + СеF4 = К2СеF6
В кислых растворах соединения церия (IV) выступают как довольно сильные окислители (ЕoСе4+/Се3+ = 1,61 В), например, окисляют концентрированную соляную кислоту:
2Се(ОН)4 + 8НСl = 2СеСl3 + Сl2 + 8Н2O
Соединения празеодима (IV) и тербия (IV) малостойки, являются сильными окислителями.
Соединения Э (II). Степень окисления +2 наиболее отчетливо проявляется у европия. Производные Еu (II), Sm (II), Yb (II) напоминают соединения элементов подгруппы кальция. Оксиды ЭО и гидроксиды Э(ОН)2 — основные соединения. Сульфаты ЭSO4, как и ВаSo4, в воде нерастворимы.
Европий часто встречается в составе минералов элементов подгруппы кальция. Минералы же, содержащие РЗЭ в состоянии окисления +3, европием обычно бедны. Этот факт также свидетельствует о достаточной устойчивости у европия степени окисления +2.
Производные лантаноидов (II) являются восстановителями.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2888; Нарушение авторских прав?; Мы поможем в написании вашей работы!