
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Семейство лантаноидов
|
|
|
|
F-Элементы 5-го и 6-го периодов периодической системы
f -Элементы (как и d -элементы) относят к переходным элементам. Они расположены в 6-м (4 f -элементы) и 7-м (5 f -элементы) периодах периодической системы. 4 f -Элементы объединяют в семейство лантаноидов, а 5 f -элементы — в семейство актиноидов. f -Элементы обычно помещают в III группу — в подгруппу скандия.
К лантаноидам относятся: церий Се, празеодим Рг, неодим Nd, прометий Рm, самарий Sm, европий Еu, гадолиний Gd, тербий Тb. диспрозий Dу, гольмий Но, эрбий Еr, Тулий Тm, иттербий Уb и лютеций Lu.
Электронная конфигурация атомов лантаноидов может быть выражена общей формулой 4 f 2-145 s 25 р 65 d 0-16 s 2. У них достраивается третий снаружи слой (4 f -подслой) при одинаковом числе электронов наружного (6 s 2) и у большинства лантаноидов преднаружного (5 s 25 р 6) слоя. Согласно химическим и спектроскопическим данным при большой энергетической близости 4 f - й 5 d -состояний для лантаноидов 4 f -состояние оказывается все же энергетически более выгодным. Поэтому в их атомах (кроме Gd) 5 d -электрон в отличие от Lа переходит в 4 f -состояние.
По характеру заполнения 4 f -орбиталей элементы семейства лантаноидов разделяются на подсемейства. Первые семь элементов Се—Gd), у которых в соответствии с правилом Хунда 4 f -орбитали заполняются то одному электрону, объединяются в подсемейство церия; семь остальных элементов (Тb—Lu), у которых происходит заполнение 4 f -орбиталей по второму электрону, объединяются в подсемейство тербия:
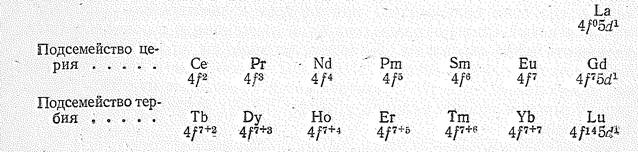 Дополнительный электрон (сверх устойчивой конфигурации f 7 и f 14) у Gd и Lu, как и у лантана, находится в 5 d -состоянии.
Дополнительный электрон (сверх устойчивой конфигурации f 7 и f 14) у Gd и Lu, как и у лантана, находится в 5 d -состоянии.
При незначительном возбуждении один из 4 f -электронов (реже два) переходит в 5 d -состояние. Остальные же 4 f -электроны, экранированные от внешнего воздействия 5 s 25 р 6-электронами, на химические свойства большинства лантаноидов существенного влияния не оказывают. Таким образом, свойства лантаноидов в основном определяют 5 d 16 s 2-электроны. Поэтому лантаноиды проявляют большое сходство с d -элементами III группы — скандием и его аналогами. Наибольшее сходство с лантаноидами проявляют иттрий и лантан, атомные и ионные радиусы которых близки к таковым у элементов семейства.
Поскольку отличие в структуре атомов элементов семейства проявляется лишь в третьем снаружи слое, мало влияющем на химические свойства элементов, лантаноиды очень сходны друг с другом. Благодаря особой близости свойств часто лантаноиды совместно с лантаном; иттрием, а также скандием объединяют в одно семейство — семейство редкоземельных элементов РЭЭ.
При исключительной близости свойства лантаноидов, однако, все же отличаются; при этом некоторые их свойства в ряду Се—Lu изменяются монотонно, другие — периодически. Монотонное изменение свойств объясняется лантаноидным сжатием — постепенным уменьшением в ряду Се—Lu атомных и ионных радиусов.
Периодический характер заполнения 4 f -орбиталей сначала по одному, а затем по два электрона предопределяет внутреннюю периодичность в изменении свойств лантаноидов и соединений.
Поскольку у лантаноидов валентными в основном являются 5 d 16 s 2-электроны, их устойчивая степень окисления равна +3. Однако элементы, примыкающие к лантану (4 f 0), гадолинию (4 f 7) и лютецию (4 f 14) имеют переменные степени окисления. Так, для церия (4 f 26 s 2) наряду со степенью окисления +3 характерна степень окисления +4. Это связано с переходом двух 4 f -электронов в 5 d -состояние. По той же причине степень окисления +4 может проявлять и празеодим (4 f 36 s 2) (хотя она и значительно менее характерна, чем для Се). Европий, имеющий семь 4 f -электронов (4 f 76 s 2), может, напротив, проявлять степень окисления +2.
Аналогичное соотношение имеет место и для элементов подсемейства тербия. (Правда, вследствие спаривания 4 f -электронов оно выражено менее отчетливо). Тербий (4 f 96 s 2) и диспрозий (4 f 106 s 2) могут проявлять степень окисления +4, а иттербий (4 f 146 s 2) и тулий (4 f 136 s 2) + 2. Периодический характер изменения степеней окисления виден из следующего сопоставления:
 Различия в свойствах элементов семейства, связанные с лантаноидным сжатием и характером заполнения 4 f -орбиталей, конечно, невелики. Однако на общем фоне поразительно большого сходства эти различия имеют важное значение, в частности, для отделения лантаноидов друг от друга.
Различия в свойствах элементов семейства, связанные с лантаноидным сжатием и характером заполнения 4 f -орбиталей, конечно, невелики. Однако на общем фоне поразительно большого сходства эти различия имеют важное значение, в частности, для отделения лантаноидов друг от друга.
По содержанию в земной коре лантаноиды не уступают таким элементам, как иод, сурьма, медь. Но они очень рассеяны в природе.
Известно, например, более 250 минералов, содержащих лантаноиды. Лантаноиды с четными порядковыми номерами более распространены, чем с нечетными.
Лантаноиды с нечетными номерами имеют лишь по одному природному изотопу (за исключением европия и лютеция, имеющих по два изотопа). Лантаноиды с четными номерами имеют по семь изотопов (кроме эрбия и церия, имеющих соответственно шесть и четыре природных изотопа). Для всех РЗЭ получены искусственные радиоактивные изотопы, образующиеся, в частности, в ядерных реакторах.
Элементы семейства встречаются в природе всегда вместе друг с другом, а также с лантаном и иттрием. Наиболее важными минералами для извлечения РЗЭ являются моноцит ЭРО4, бастнезит ЭFСО3, лопарит (Та,Са,Э)2(Тi,Nb,Та)2О6 и т.д.
Прометий радиоактивный элемент, в земной коре практически не встречается. Он был обнаружен в 1947 г. в продуктах деления ядер урана в атомных реакторах; его получают искусственным путем.
Простые вещества. В виде простых веществ лантаноиды тугоплавкие серебристо-белые металлы (Рr и Nd слегка желтоватого цвета). Некоторые константы их (и для сравнения лантана) приведены ниже:
Как видно из приведенных данных, от Се к Lu в изменении плотности, температуры плавления и кипения проявляется внутренняя периодичность. Минимальные значения этих констант приходятся на Еu и Yb. 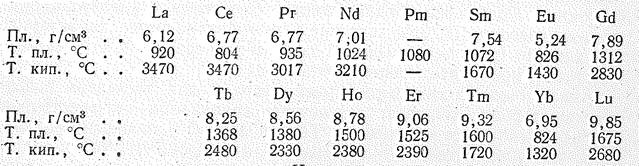
Лантаноиды ковки, имеют относительно невысокую твердость, по элекрической проводимости сходны с ртутью.
По химической активности лантаноиды, как и Lа, уступают лишь щелочным и щелочноземельным металлам. Компактные металлы, правда, довольно устойчивы к сухому воздуху. Во влажном же воздухе они быстро тускнеют. При нагревании (до 200— 400 °С) лантаноиды воспламеняются на воздухе и сгорают с образованием смеси оксидов и нитридов. Церий в порошкообразном состоянии даже пирофорен, т. е. самовоспламеняется на воздухе при обычных условиях. Пирофорность церия и ряда других лантаноидов, используется для получения пирофорных сплавов — «кремней» зажигалок, трассирующих пуль и др.
Лантаноиды взаимодействуют с галогенами, а при нагревании с азотом, серой, углеродом, кремнием, фосфором, водородом. С большинством металлов они дают сплавы. При этом часто образуются интерметаллические соединения.
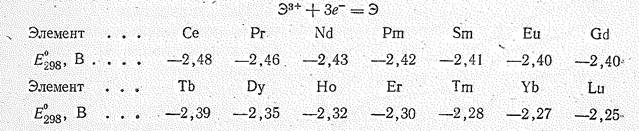 Об активности лантаноидов свидетельствуют также значения их электродных потенциалов:
Об активности лантаноидов свидетельствуют также значения их электродных потенциалов:
Находясь в ряду напряжений далеко впереди водорода, лантаноиды окисляются водой, особенно горячей, выделяя водород. Тем более активно они взаимодействуют с кислотами. В НF и Н3РО4 лантаноиды устойчивы, так как покрываются защитными пленками нерастворимых солей. В щелочах не растворяются.
Вследствие. большой близости свойств лантаноидов разделение их — одна из труднейших задач химической технологии. В настоящее время разделяют РЗЭ с помощью ионообменных смол и экстракцией соединений органическими растворителями.
Лантаноиды в металлическом состоянии обычно получают восстановлением с помощью кальция хлоридов или фторидов.
Редкоземельные металлы в последнее время приобрели большое значение. Исключительная способность их соединяться со многими - газами используется в вакуумной технике. В металлургии они применяются как легирующие добавки для улучшения механических свойств сплавов. Лантаноиды и их соединения используются в качестве катализаторов в органических и неорганических синтезах, а также в качестве материалов в радио- и электротехнике, в атомной энергетике.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2285; Нарушение авторских прав?; Мы поможем в написании вашей работы!