
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения актиноидов
|
|
|
|
Соединения Э (III). Степень окисления +3 проявляют все актиноиды. Однако для первых элементов семейств (Тh—Pu) степень окисления +3 не характерна (особенно для Тh и Ра); их немногочисленные соединения устойчивы лишь в твердом состоянии.
Свойства соединений актиноидов (III) (если не учитывать различий в окислительно-восстановительной активности) сходны и с соответствующими соединениями лантаноидов (III). Сходство химического поведения ионов лантаноидов (III) и актиноидов (III) в водных растворах обнаружено, например, при их ионнообменном разделении. Сходство кристаллических структур, растворимости, характера гидролиза, состава кристаллогидратов и других свойств обнаружено также у однотипных соединений в твердом состоянии.
Гидроксиды актиноидов Э(ОН)3, подобно гидроксидам лантаноидов (III), мало растворимы в воде и проявляют отчетливо выраженные основные свойства. В частности, они легко взаимодействуют с кислотами.
Из соединений рассматриваемых элементов в воде растворимы Э(NO3)3, ЭСl3, ЭВr3, ЭI3, Э2(SO4)3, трудно растворимы ЭF3, ЭРО4 и др.
Соединения Тh (III), Ра (III), U (III) и Nр (III) — сильные восстановители. Например, они разлагают воду:
2UСl3 + 4Н2O = 2U(ОН)2Сl2 + Н2 + 2НСl
Восстановительная активность производных Рu (III) проявляется менее энергично. Однако в растворах они довольно легко окисляются кислородом воздуха.
Соединения Э (IV). Степень окисления +4 наиболее типична для тория и плутония, а также проявляется у протактиния, урана, нептуния, америция и кюрия.
В химическом отношении актиноиды (IV) сходны друг с другом и с церием (IV), а также с d -элементами IV группы (подгруппа титана).
Для актиноидов (IV) известны изоморфные кристаллические оксиды ТhО2 — белого, РаO2 — коричнево-черного, UО2 — коричневого, NрO2 — желтого, АmO2 — черного цветов. Некоторые из них тугоплавки (температура плавления ТhO2, например, 3050 °С, UO2 2176 °С). ЭO2 в воде практически не растворяются и с ней химически не взаимодействуют; практически не растворяются и в разбавленных кислотах. Со щелочами не взаимодействуют даже при сплавлении.
Гидроксиды Э(ОН)4 проявляют довольно слабо выраженные основные свойства. Получают Э(ОН)4 по обменным реакциям.
У актиноидов (IV) хорошо растворимы в воде нитраты, умеренно — сульфаты, плохо фосфаты, карбонаты, иодаты и др. Растворимые соединения сильно гидролизуются.
Кристаллогидраты актиноидов (IV) обычно содержат 4—12 молекул воды, например Тh(NО3)4×4Н2O, Тh(NО3)4×12Н2O, Тh(SO4)2×4Н2O. Весьма характерны также производные анионных комплексов актиноидов (IV), например К[Тh(NO3)5], К4[Тh(SO4)4(OН2)2], К2ЭF6.
Из тетрагалогенидов ЭНаl4 тетрафториды известны для всех актиноидов подсемейства тория. Они довольно тугоплавки, труднорастворимы в воде. Тетрахлориды получены для Тh, Ра, U, Nр; тетрабромиды и тетраиодиды известны лишь для Тh, U и Np.
Соединения актиноидов (IV) имеют сложную структуру. Их координационные числа большие (6—12).
Производные Аm (IV) и Сm (IV) — сильные окислители. Они, например, окисляют концентрированную соляную кислоту:
2АmО2 + 8НСl = 2АmСl3 + Сl2 + 4Н2O
Для восстановления соединений U(IV) и Nр (IV) требуются сильные восстановители, например водород в момент выделения. Наоборот, перевести U (IV) и Nр (IV) в более высокую степень окисления довольно легко даже такими окислителями, как I2. Fе3+, НNО3:
3UO2 + 8НNO3 = 3UО2(NО3)2 + 2NO + 4Н2O
2Nр(NО3)4 + I2 + 4Н2O = 2NpО2NО3 + 6НNО3 + 2НI
Соединения Э (V). Состояние окисления +5 наиболее устойчиво для протактиния и нептуния, реже проявляется у плутония. Актиноиды (V) ведут себя, как d-элементы, и обнаруживают сходство с элементами подгруппы ванадия. В отличие от последних однотипные соединения актиноидов (V) в большей степени проявляют основные свойства.
Так, Ра2O5 кислотных признаков практически не проявляет даже при сплавлении с содой. Напротив, Ра2O5 заметно растворяется в горячей серной кислоте:
Ра2O5 + Н2SO4 = (РаO2)2SO4 + Н2O
То же самое можно сказать и о гидроксиде протактиния (V) среднего состава НРаО3. Этот гидроксид в воде не растворяется, по химической природе является слабым основанием типа РаO2(ОН) с некоторыми кислотными признаками. Так, он относительно легко взаимодействует с кислотами, образуя производные радикала – РаO2+, называемого протактинилом:
РаО2(ОН) + НСl = РаО2Сl + Н2O
Кислотные же признаки НРаО3 выражены в столь малой степени, что даже при сплавлении со щелочами устойчивых протактинатов (V) получить не удается.
Аналогично ведут себя оксиды и гидроксиды урана (V), нептуния (V) и плутония (V). Для указанных элементов наиболее устойчивы в водных растворах производные сложных катионов типа ЭО2+, например UО2Сl, NрО2F, РuО2Сl.
Из других производных актиноидов (V) выделены в свободном состоянии фториды РаF5, UF5, NрF5; хлориды РаСl5, IUСl5; бромид РаВr5 и некоторые другие. Все эти соединения летучи, в водных растворах гидролизуются почти нацело:
РаСl5 + 3Н2O = НРаО3 + 5НСl
Из производных анионных комплексов актиноидов (V) можно назвать комплексные фториды типа M[ЭF6], по устойчивости напоминающие двойные соли.
Соединения Аm (V) и Рu (V) малочисленны и проявляют окислительные свойства:
2АmО2F + 2Н2O2 + 3Н2SO4 = Аm2(SO4) + 2О2 + 2НF + 4Н2O
Соединения Э (VI). Степень окисления +6 наиболее характерна для урана и может проявляться у нептуния, плутония и реже у америция. При этой степени окисления актиноиды напоминают d -элементы VI группы (подгруппа хрома).
Во многих соединениях урана и других актиноидов, находящихся в высшей степени окисления Э (V) и Э (VI), имеются атомные группировки ЭO2+ и ЭО22+, сохраняющиеся без изменения при разнообразных химических реакциях. Эти группировки называют актинильными: UО22+ — уранил, NpО22+— нептунил, РаО22+ — проатактинил и т. д.
Особая устойчивость таких группировок объясняется тем, что между атомами актиноида и кислорода осуществляется тройная связь. Две из связей образуются за счет двух непарных электронов атома актиноида и двух непарных электронов атома кислорода, третья связь образуется за счет неподеленной электронной пары атома кислорода и свободной орбитали атома актиноида:
 Актинильная группировка атомов входит в состав как катионных, так и анионных комплексов, имеющих форму бипирамиды (гекса-, пента- и тетрагональной). На вертикальной оси бипирамиды расположена группировка ОЭО с короткими расстояниями dЭО, а расстояния между атомами актиноида и другими атомами в экваториальной плоскости более длинные. Поэтому такие комплексы можно трактовать как содержащие группировку ЭО2 с прочными связями ЭО, к которой присоединены за счет более слабого взаимодействия другие атомы или их группировки. Так, например, UО2(NO3)2×6Н2O (желтые кристаллы) имеет островную структуру, состоит из ионов UO2(ОН2)52+ и NО3-,
Актинильная группировка атомов входит в состав как катионных, так и анионных комплексов, имеющих форму бипирамиды (гекса-, пента- и тетрагональной). На вертикальной оси бипирамиды расположена группировка ОЭО с короткими расстояниями dЭО, а расстояния между атомами актиноида и другими атомами в экваториальной плоскости более длинные. Поэтому такие комплексы можно трактовать как содержащие группировку ЭО2 с прочными связями ЭО, к которой присоединены за счет более слабого взаимодействия другие атомы или их группировки. Так, например, UО2(NO3)2×6Н2O (желтые кристаллы) имеет островную структуру, состоит из ионов UO2(ОН2)52+ и NО3-,
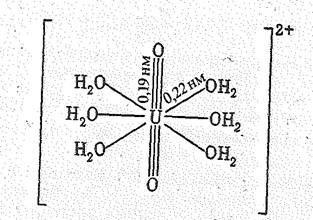
Комплекс UО2(ОН2)62+ имеет структуру гексагональной бипирамиды с атомом урана а центре:
| 
|
Структура К3[UО2F5] – островного типа, состоит из ионов К+ и UO2F53- последний представляет собой пентагональную бипирамиду с атомом урана в центре. Атомы кислорода расположены на вертикальной (пятерной) оси бипирамиды (схема вверху, справа).
Аналогичным образом построены и многие другие соединения актиноидов высших степеней окисления Так, структурной единицей UО2F2 является гексагональная бипирамида UО2F6, образующая плоские полимерные слои состава UО2F2, в которых атомы кислорода расположены над и под слоями. Кристаллы МgUО4 состоят из сплющенных октаэдров UO6, объединенных за счет общих ребер а цепи состава [(UO2)O2]2-

между которыми находится ионыMg2+.
У гидроксидов состава Н2ЭО4 основные свойства преобладают над Кислотными, и по химическому поведению их можно рассматривать как основания типа ЭО2(ОН)2. Эти гидроксиды довольно легко взаимодействуют с кислотами, образуя производные актинильных катионов ЭО22+, например:
ЭО2(ОН)2 + 2НNО3 = ЭО2(NO3)2 + 2Н2О
Такого же типа производные образуются при взаимодействии UО3 с кислотами.
UО3 + 2HCl = UО2Сl2 + H2O
Большинство производных ЭО22+ хорошо кристаллизуются и легко растворяются в воде, являются солями и солеподобными соединениями. Уместно вспомнить, что для СrО22+, МоО22+ и WO22+ известны лишь кислотные СrО2Наl2 или напоминающие их МоО2Наl2 и WO2Наl2. Гидролиз производных ЭО22+ обратим:
UO2(NO3)2 + 2Н2О = UO2(ОН)2 + 2НNO3
Нитрат уранила UO2(NO3)2 наиболее распространенный в химической практике препарат урана.
Кислотные признаки Н2ЭО4 проявляют лишь при сплавлении со щелочами:
Н2ЭО4 + 2КОН = К2ЭО4 + 2Н2О
Получаемые при этом уранаты (VI), нептунаты (VI), плутонаты (VI) малостойки и водой разрушаются.
В ряду U – Np – Pu – Am устойчивость производных Э (VI) понижается Так, для урана получен устойчивый оксид ОU3 (оранжевого цвета). Для нептуния лишь смешанный оксид Np3О8 - нептунат (VI) нептуния (IV) Np(NрО4)2, а оксид плутония (VI) не получен вообще. Таким же образом падает устойчивость и фторидов UF6 и NрF6 более или менее устойчивые летучие вещества, а РuF6 неустойчив. Из других галогенидов относительно стоек лишь UСl6, а хлориды Nр (VI) и Рu (VI) не получены. Бромид и иодиды не получены даже для U (VI).
Производные Nр (VI), особенно Рu (VI) и Аm (VI), -сильные окислители:
2NрО2Сl2 + SnС12 = 2NрO2Сl + SnС14
Соединения Э (VII). При действии активных окислителей (О3, СlО-, ВrO-) на сильнощелочные растворы оксонептунатов (VI) и оксоплутонатов (VI) образуются соединения нептуния (VII) и плутония (VII), например:
2NрO42- + О3 + 2OН- = 2NрО53- + O2 + Н2O
Из этих растворов можно выделить оксонептунаты (VII) и оксоплутонаты (VII) типа Ва3(NpО5)2×nН2O и - Ва3(РuО5)2×nН2О, [Co(NН3)6]NрO5×3Н2O и др. Производные NрО53- имеют темно-зеленую, а РuO53- - коричнево-черную окраску. Получен также гидроксид состава NpО2(ОН)3 буровато-черный осадок. Обладает амфотерными свойствами легко растворяется в щелочах давая зеленые растворы (анион NрО53-), и в кислотах образуя желто-коричневые растворы в которых обнаруживаются ионы NрО23+. Однако в кислых растворах соединения Nр (VII) быстро переходят в соединения Nр (VI). Получены соединения Аm (VII). Степень окисления + 7 у актиноидов впервые обнаружили советские ученые (Н. Н. Крот, А. д. Гельман и др.),
Производные нептуния (VII) и в особенности плутония (VII) и америция (VII) проявляют сильные окислительные свойства. Имеются сообщения о получении производных Np (VIII) и Ru (VII).
[1] В этом случае f-сжатие называется лантаноидным.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2619; Нарушение авторских прав?; Мы поможем в написании вашей работы!