
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения элементов подгруппы кобальта
|
|
|
|
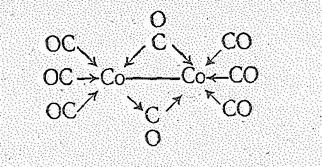 Соединения Со (0), Rh (0), Ir (0). Для кобальта и его аналогов в степени окисления О известны карбонилы. Простейший карбонил кобальта Cо2(CО)3 — двухъядерное соединение:
Соединения Со (0), Rh (0), Ir (0). Для кобальта и его аналогов в степени окисления О известны карбонилы. Простейший карбонил кобальта Cо2(CО)3 — двухъядерное соединение:
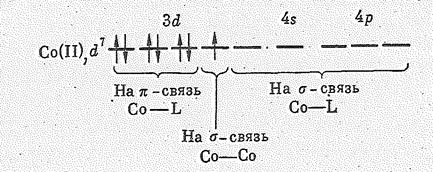
 Строение молекулы октакарбонила можно объяснить следующим образом. В ней атомы Со образуют по шесть s-связей. Четыре связи обязаны донорно-акцепторному взаимодействию электронных пар четырех молекул СО и свободных орбиталей Со. Пятая связь образуется при участии одной d -электронной пары атома Со и свободной p-орбитали молекулы СО. Связь Со—Со образуется за счет непарных электронов двух атомов кобальта. Стабилизация молекулы достигается за счет p-связей, на образование которых используются 3 d e6-электроны атома кобальта:
Строение молекулы октакарбонила можно объяснить следующим образом. В ней атомы Со образуют по шесть s-связей. Четыре связи обязаны донорно-акцепторному взаимодействию электронных пар четырех молекул СО и свободных орбиталей Со. Пятая связь образуется при участии одной d -электронной пары атома Со и свободной p-орбитали молекулы СО. Связь Со—Со образуется за счет непарных электронов двух атомов кобальта. Стабилизация молекулы достигается за счет p-связей, на образование которых используются 3 d e6-электроны атома кобальта:
Октакарбонил Со2(СО)8 получают, нагревая порошок Со в атмосфере СО (при 150—200 °С и 2,5×107 Па). Октакарбонил — оранжевые кристаллы (Tпл. 51 °С), нерастворимые в воде, но хорошо растворимые в органических растворителях. При 60 °С октакарбонил кобальта начинает разлагаться.
При нагревании Со3(СО)8 под давлением водорода образуется гидрокарбонил (карбонилгидрид), который можно рассматривать как производное кобальта в степени окисления —1:
Со3(СО)8 + Н2 = 2Н[Со(СО)4]
Известны также соли типа К[Со(СО)4], NН4[Со(СО)4]. В отличие от них производные типа Zn[Со(СО)4]2, Са[Со(СО)4]3 являются ковалентными соединениями — смешанными карбонилами кластерного типа со связью М—Со.
В ряду гидрокарбонилов НМn(СО)5—Н2Fе(СО)4—НСо(СО)4 сила кислот увеличивается, а устойчивость, наоборот, уменьшается. Известны также производные [Rh(СО)4]-.
Для кобальта (0) выделены четырехъядерньтй карбонил Со4(СО)12 (черный, Тразл. 60 оС), а также жидкие Со(NО)(СО)3 и Со(NО)(РF3)3. Получены также карбонилы родия и иридия состава Э2(СО)8, Э4(СО)12, Э6(СО)6.
Соединения Со (II). Степень окисления +2 характерна для кобальта. При этой степени окисления у него устойчивы координационные числа 6 и 4, что соответствует октаэдрическому и тетраэдрическому распределению s-связей. Большинство соединений кобальта (II) парамагнитны:

В отличие от Fе (II) и большинства других d -элементов IV периода тетраэдрические комплексы Со (II) весьма разнообразны, что объясняется устойчивостью электронной конфигурации (p d pазp)4(s d pазp)3,
Октаэдрическая структурная единица лежит в основе строения координационных кристаллов СоО (тип NаСl) и СоF2 (тип рутила), слоистых кристаллов СоСl2 и Со(ОН)2.
Оксид кобальта (II) СоО серо-зеленые кристаллы, образуется при взаимодействии простых веществ или термическим разложением Со(ОН)2, СоСО3. дигалогениды СоНаl2 также образуются при взаимодействии простых веществ или обезвоживанием соответствующих кристаллогидратов. дигалогениды (кроме СоF2) растворимы в воде. Гидроксид Со(ОН)2 существует в виде синей и розовой модификаций. Синяя модификация получается при действии щелочей на соли Со(II) на холоду; при нагревании Со(ОН)2 переходит в розовую модификацию. В воде Со(ОН)2 не растворяется. По химической природе он, как и СоО, амфотерное соединение преимущественно проявляющее основные свойства.
Из катионных комплексов для Со (II) наиболее характерны аквокомплексы [Со(ОН2)6]2-, придающие растворам ярко-розовую окраску. Эта же окраска (а также красная) характерна для кристаллогидратов Со (И): Со (NО3)2×6Н2O, СоSО4×6Н2O, СоSО4×7Н2O и др. Последние образуются при взаимодействии с кислотами СоО или Со (ОН)2.
При нагревании или под действием водоотнимающих веществ (СаСl2, спирт и др.) окраска кристаллогидратов Со (П) меняется, что связано с изменением характера координации лигандов и появлением многоядерных комплексов. Например, нагревание кристаллогидратов СоСl2 сопровождается следующим 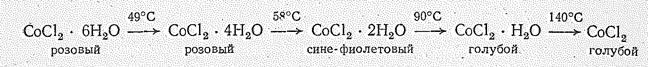 изменением их состава и окраски:
изменением их состава и окраски:
При действии воды на безводный СоСl2 снова образуются кристаллогидраты. Водный раствор СоСl2 применяется для изготовления индикаторной бумаги, которая служит для определения влажности, поскольку в сухом состоянии эта бумага синего цвета, а во влажном — розовая.
Изменение окраски в указанном ряду обусловлено изменением характера координации молекул Н2О и ионов Сl вокруг атома Со (II), а следовательно, изменением величины D. Структурной единицей розовых кристаллов СоСl2×6Н2О и СоСl2×4Н2О являются октаэдры [Со(OН2)4Сl2], сине-фиолетовых кристаллов СоСl2×2H2О октаэдры [Со(OН2)2Сl4], а голубых кристаллов СоСl2×Н2O и СоСl2 — октаэдры СоСl6.
Безводные галогениды, роданид, сульфат и другие производные могут присоединять молекулы аммиака с образованием гексаамминкомплекса [Со(NН3)6]2+. Аммиакаты Со (II) устойчивее, чем Fе (II), но всё же водой разрушаются:
[Со(NН3)6]С12 + 2Н2O = Со(ОН)2 + 4Н3N + 2NН4Сl
Поэтому их образование в растворах достигается при большом избытке аммиака и в присутствии NН4С1.
Аммиакаты Со (II) в растворах легко окисляются даже молекулярным кислородом воздуха за счет перехода в низкоспиновый комплекс Со(III):
Анионные комплексы Со (II) обычно имеют тетраэдрическую структуру [СоХ4]2- (Х = Сl-, Вr-, I-; SСN-, ОН-), окрашены в си ний и фиолетовый цвета. Они образуются при взаимодействии соответствующих соединений Со (II) с однотипными основными соединениями. Так, при нагревании Со(ОН)2 с концентрированными щелочами образуется [Со(ОН)4]2-:
ний и фиолетовый цвета. Они образуются при взаимодействии соответствующих соединений Со (II) с однотипными основными соединениями. Так, при нагревании Со(ОН)2 с концентрированными щелочами образуется [Со(ОН)4]2-:
2NаОН + Со(ОН)2 = Nа2[Со(ОН)4]
а при взаимодействии концентрированных растворов СоСl2 и соляной кислоты — [СоС14]2-. В присутствии основных гаогенидов из солянокислых растворов СоСl2 можно выделить соли М+12[СоСl4].
Большинство производных анионных комплексов Со (II) — кобальтаты М+12[СоНаl4], М+12[Со(ОН)4], М+12[Со(SСN)4] и другие по устойчивости относятся к двойным солям; при разбавлении растворов ионы [СоХ4]2- обычно разрушаются. Реакция образования синего роданидокобальтата (II)
2КSСN + Со(SСN)2 = К2[Со(SСN)4]
используется для определения кобальта (II) при анализе. От сильного разбавления водой К2[Со(SСN)4] разрушается и окраска раствора становится розовой за счет появления ионов [Со(ОН2)6]2+:
[Со(SСN)4]2- + 6Н2O = [Со(OН2)6]2+ + 4SСN-
Рассмотренные октаэдрические ионы — высокоспиновые комплексы с электронной конфигурацией (а)
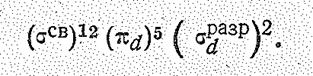 а а
| 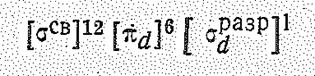 б б
|
Низкоспиновые октаэдрические комплексы с электронной конфигурацией (б) для Со (II) не характерны. Они — сильные восстановители, Например:
[СО(СN)6]3- + 1е = [Со(СN)6]4-, Еo = 0,83 В.
Это объясняется тем, что вследствие большого значения параметра расщепления D энергетический уровень sразр-орбитали расположен. довольно высоко. Поэтому электрон с sразр-орбитали легко удаляется и образуются низкоспиновые октаэдрические комплексы Со (III), например:
 Для Со (II), как и для других атомов и ионов с конфигурацией d 7, с лигандами сильного поля типа СN- более характерны димерные комплексы со связью металл—мета
Для Со (II), как и для других атомов и ионов с конфигурацией d 7, с лигандами сильного поля типа СN- более характерны димерные комплексы со связью металл—мета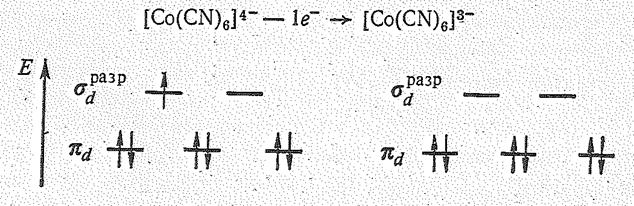 лл:
лл:
Поэтому комплексные цианиды Со (II) отличаются от таковых Fе (II). При добавлении КСN к растворам Со (II) можно получить соль состава К6[Со2(СN)10] (пурпурного цвета). Комплекс [Со2(СN)10]6- имеет структуру, аналогичную структуре Мn2(СО)10.
 Высокоспиновые комплексы, напротив, характеризуются низким значением D, и энергетическое различие sразр- и p d -орбиталей незначительно. Высокоспиновый комплекс СоF64- окисляется лишь наиболее сильными окислителями:
Высокоспиновые комплексы, напротив, характеризуются низким значением D, и энергетическое различие sразр- и p d -орбиталей незначительно. Высокоспиновый комплекс СоF64- окисляется лишь наиболее сильными окислителями:
Соединения Со (III), Rh (III), Ir (III). В степени окисления +3 для кобальта, родия и иридия очень, характерны многочисленные катионные, анионные и нейтральные комплексы, в которых они шестикоординационны. Почти все они диамагниты, парамагнитен ион СоF63-.
Бинарные соединения и соли для Со (III) нехарактерны. Относительно устойчив лишь коричневый Со3O4, который представляет собой смешанный: оксид Со+2Со+32О4. Его получают осторожным нагреванием Со(NО3)2. Оксид этот — сильный окислитель.
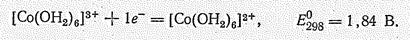 Для родия (III) и иридия (III) известны оксиды Э2О3, гидроксиды Э(ОН)3 (точнее Э2О3×nН2O), галогениды ЭНаl3 и ряд других соединений, в частности соли типа Э2(SO4)3, Rh(NО3)3. Соединения Ir (III) более или менее легко окисляются, переходя в производные Ir (IV). Например, Ir(ОН)3 на воздухе переходит в Ir(ОН)4, при нагревании до 400 oС Ir2O3 диспропорционирует на IrO и Ir. Все соединения рассматриваемых элементов окрашены. Аквокомплексы Со (III) не стабильны, так как являются сильными окислителями:
Для родия (III) и иридия (III) известны оксиды Э2О3, гидроксиды Э(ОН)3 (точнее Э2О3×nН2O), галогениды ЭНаl3 и ряд других соединений, в частности соли типа Э2(SO4)3, Rh(NО3)3. Соединения Ir (III) более или менее легко окисляются, переходя в производные Ir (IV). Например, Ir(ОН)3 на воздухе переходит в Ir(ОН)4, при нагревании до 400 oС Ir2O3 диспропорционирует на IrO и Ir. Все соединения рассматриваемых элементов окрашены. Аквокомплексы Со (III) не стабильны, так как являются сильными окислителями:
Ионы [Со(ОН2)6]3+ окисляют даже воду. Поэтому, например, при взаимодействии Со3O4 с кислотами выделяется кислород:
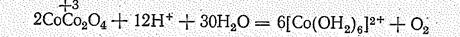
а при взаимодействии с концентрированной соляной кислотой хлор.
Из катионных комплексов для Со (III) и его аналогов весьма устойчивы многочисленные аммин-комплексы, для гексааммин-иона [Со(NН3)6]3+ (желтого цвета), например, не наблюдается сколько-нибудь заметной диссоциации в растворах (Кнест = 6×10-36); он устойчив по отношению к концентрированной НСl и медленно разрушается лишь Н2S и NаОН. Ион [Со(NН3)6]3+ образует многочисленные хорошо кристаллизующиеся соли с целым рядом анионов, простые производные Со (III) для которых неизвестны.
Для кобальта (III) и его аналогов весьма разнообразны катионные комплексы, в которых NH3-группы частично замещены на другие лиганды, например i[Э(NН3)5(OН2)]X3, [Э(NН3)5X]X2, [Э(NН3)4Х2]Х и др. (где Х — чаще всего Сl- и NO2-). В соответствии с этим окраска комплексов изменяется, например [Со(NН3)6(ОН2)]3+ -красного, [Со(NН3)5Сl]2+ -малиново-красного, а [Со(NН3)4С12]+ может быть зеленого (транс-изомер) и синего (цис-изомер) цветов.
Среди кобальтов (III), родиатов (III) и иридатов (III) весьма многочисленны и часто очень устойчивы соединения типа М+13[Э(СN)6] и М+13[Э(NО2)6].
Примерами гексанитритокобальтатов (III) могут служить труднорастворимьге в воде производные элементов подгруппы калия М+13[Со(NО2)6]. Образованием желтого осадка К3[Со(NO2)6] часто пользуются для обнаружения ионов К+ при анализе. У калия, его аналогов и NН4- плохо растворимы также гексанитритородиаты (III) и гексанитритоиридаты (III).
Взаимодействие производных Со (II) с КСN в присутствии окислителя ведет к образованию гексацианокобальтата (III) калия К3[Со(СN)6] (бледно-желтого цвета). Выделена также сильная трехосновная кислота Н3[Со(СN)6]. По многим свойствам на гексацианокобальтат (III) калия весьма похожи бледно-желтый К3[Rh(СN)6] и бесцветный К3[Ir(СN)6].
В отличие от Со (III) комплексные галогениды у Rh (III) и Ir (III) очень устойчивы. Так, при взаимодействии RhСl3 с НСl получается хорошо растворимая в воде гексахлорородиевая кислота Н3[RhСl6], соли которой (гексахлорородиаты) обычно ярко-красного цвета. Зеленый гексахлороиридат (III) натрия Nа3[IrСl6] служит исходным продуктом при получении других производных иридия (III).. Получают его восстановлением Na2[IrСl6]. У Со (ПI) выделено лишь фтористое производное К3[СоF6]. Известны также двойные сульфаты типа квасцов M+1Э(SО4)2×12Н2O.
Кроме катионных и анионных комплексов для Со (ПI) и его аналогов известны многочисленные нейтральные комплексы, которые можно рассматривать как промежуточные продукты при переходе от катионных к анионным комплексам, например при переходе от [Со(NН3)6]3+ к [Со(NО2)6]3-:
или при переходе от [Rh(NН3)6]3+ к [RhСl6]3-:
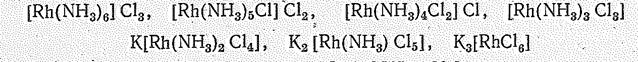 Образование нерастворимого [Rh(NН3)3Сl3] используется для отделения Rh от других платиновых металлов. При прокаливании [Rh(NН3)3Сl3] в токе водорода получают металлический родий.
Образование нерастворимого [Rh(NН3)3Сl3] используется для отделения Rh от других платиновых металлов. При прокаливании [Rh(NН3)3Сl3] в токе водорода получают металлический родий.
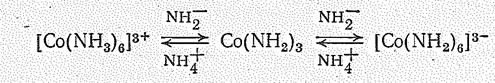 Переход от катионных комплексов Со (III) к анионным и обратно можно осуществить и в жидком аммиаке. Так, дигидронитрид (амид) Со(NН2)3, будучи амфотерным соединением, реагирует как с аммонокислотами (например, с NН4Сl), так и с аммонооснованиями (например, с КNН2). Это можно выразить следующей суммарной схемой:
Переход от катионных комплексов Со (III) к анионным и обратно можно осуществить и в жидком аммиаке. Так, дигидронитрид (амид) Со(NН2)3, будучи амфотерным соединением, реагирует как с аммонокислотами (например, с NН4Сl), так и с аммонооснованиями (например, с КNН2). Это можно выразить следующей суммарной схемой:
Растворение полимерного Со(NН2)3 обусловливается постепенным разрывом амидных мостиков (—NH2—). При этом в аммонокислотах координационное насыщение Со (III) достигается за счет молекул Н3N:

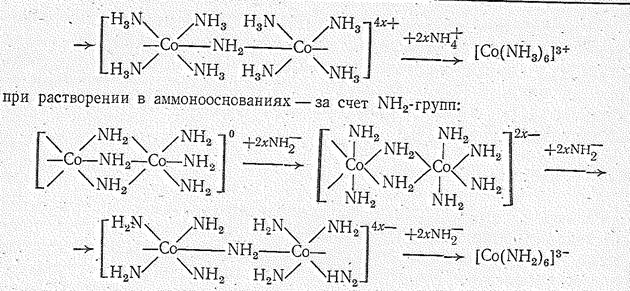
Многоядерные комплексы образуются также при аммонолизе аммиакатов Со (III) например:
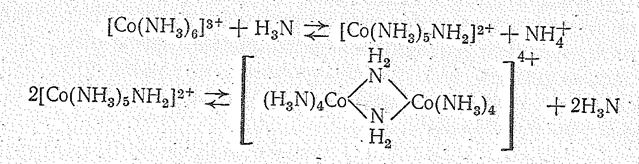 Кроме того, возможны смешанные гидроксодинитридоаммин-комплексы:
Кроме того, возможны смешанные гидроксодинитридоаммин-комплексы:

Многочисленность комплексных соединений Со(III), Rh (III) и Ir (III) обусловливается также наличием соединений-изомеров, Ниже приведены примеры комплексных соединений кобальта (III), отвечающих
координационной изомерии: [Со(NН3)6] [Сr(СN)6] и [Сr(NН3)6] [Со(СN)6];
гидратной изомерии: [Со(NН3)4Сl2]Сl×Н2O и [Со(NН3)4Сl(ОН2)]Сl2;
ионизационной изомерии: [Со(NН3)5SО4]Вг и [Со(NН3)5Вг]SO4
(красный) (красно-фиолетовый)
и геометрической изомерии:
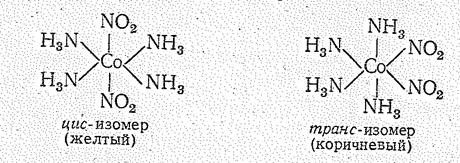
Соединения кобальта (IV), родия (IV) и иридия (IV). Степень окисления +4 характерна для иридия. Для него известны нерастворимые в воде черные оксид IrО2 и гидроксид Ir(ОН)4 (точнее IrО2×nН2O), галогениды IrНаl4. Последние при взаимодействии с водой полностью гидролизуются.
Наиболее характерны для Ir (IV) комплексные хлориды типа М+12[IrСl6] темно-красного цвета. Как указывалось, их получают хлорированием смеси порошкообразного иридия с основным хлоридом или взаимодействием IrО2 с М+1Сl в растворе соляной кислоты:
IrO2 + 4НСl + 2NаСl = Nа2[IrСl6] + 2Н2O
Из гексахлороиридатов (VI) в воде хорошо растворим Nа2[IrСl6], а производные элементы подгруппы калия и NН4+ растворимы плохо. Образование малорастворимого (NН4)2[IrСl6] используется для отделения иридия от остальных платиновых металлов, При прокаливании (NН4)2[IrСl6] (в атмосфере водорода) получается чистый иридий.
Из соединейий Rh (IV) можно назвать труднорастворимый в воде зеленый гексахлорородиат (IV) цезия Сs2[RhСl6], который является окислителем и частично отщепляет хлор уже при контакте с водой.
Соединения Rh (VI) и Ir (VI). Степень окисления +6 проявляется у иридия в гексафторидах ЭF6. Это легкоплавкие твердые вещества, RhF6 (Tпл. 70 °С) красно-коричневого, а IrF6 (Tпл. 44 °С, Tкип. 53 °С) желтого цвета. Получают их сжиганием металлов в атмосфере фтора.
Гексафториды, в особенности RhF6 неустойчивы, сильные окислители. Они энергично окисляют воду:
2IrF6 + 10Н2O = 2Ir(ОН)4 + 12НF + O2
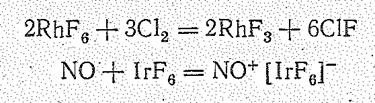 в отсутствие воды окисляют даже свободный хлор и NO:
в отсутствие воды окисляют даже свободный хлор и NO:
Из соединений элементов подгруппы кобальта наиболее широко применяют производные самого кобальта. Кроме. Рассмотренных областей применения его соединения идут для изготовления цветных эмалей и красок. В сельском хозяйстве соединения кобальта используются в качестве микроудобрений и для подкормки животных.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1483; Нарушение авторских прав?; Мы поможем в написании вашей работы!