
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения элементов подгруппы железа
|
|
|
|
Металлические и металлоподобные соединения. Подобно другим d -элементам, железо с малоактивными неметаллами образует, соединения типа металлических. Так, с углеродом оно дает карбид состава Fе3С (цементит), твердые растворы (аустенит — раствор С и g-Fе; феррит — раствор С в a-Fе), эвтектические смеси (железа с углеродом, цементита с аустенитом, железа с цементитом и др.). Изучение условий образования и свойств соединений железа с углеродом имеет большое значение для понимания структуры, состава и свойств железоуглеродистых сплавов. В зависимости от условий кристаллизации и состава расплава Fе—С структура и соотношения компонентов существенно меняются, а следовательно, изменяются и физико-химические свойства получаемых сплавов.
Железоуглеродистые сплавы, содержащие менее 0,3% С — мягкой сталью (мягким железом), содержащие до 2% С, называются сталями, содержащие 2—4% С — чугунами.
На свойства сталей большое влияние оказывает также их термическая обработка, вызывающая вторичные изменения в соотношении соединений и структуре сплавов. Так, при медленном охлаждении (отпуске) стали аустенит постепенно разлагается на цементит и феррит, и сталь становится мягкой. При быстром же охлаждении (закалке) стали аустенит превращается в мартенсит (пересыщенный твердый раствор С в a-Fе), и сталь приобретает большую твердость и некоторую хрупкость.
Физико-химические свойства железоуглеродистых сплавов изменяются еще сильнее при добавлении легирующих компонентов (Сr, Мn, Ni, Со, Тi, W‚ Мо, Сu, Si, В, V, Zr и др.). При этом легирующие элементы вступают во взаимодействие с железом и углеродом и их соединениями с образованием новых металлических и металлоподобных соединений, в результате чего происходит изменение всего комплекса механических и физико-химических свойств стали. Чугун, как известно, получают при восстановлении руд железа в доменных печах. Это описывается такой последовательностью реакций
3Fе2O3 (т) + СО (г) = 2Fе3О4 (т) + СO2 (г),
Fе3O4 (т) + СО (г) = 3FеО (т) + СO2 (г), FеO (т) + СО (г) = Fе + СO2 (г)
или FеO (т) + С (г) = Fе + СO (г)
Восстановление руды суммарно может быть выражено следующим уравнением: Fе2O3 (т) + 3СО (г) = 2Fе (т) + 3СO2 (г)
Последующей переработкой чугуна (бессемерованием, мартеновским способом, электроплавкой в вакууме и др.) получают сталь и техническое железо. Передел чугуна в сталь сводится к удалению избыточного углерода и вредных примесей (серы, фосфора) путем их окисления (выжигания) при плавке, Железо в чистом виде получают электролизом растворов его солей, термическим разложением ряда соединений.
Соединения Fе (0), Ru (0), Оs (0). Подобно элементам подгруппы марганца и хрома, железо и его аналоги способны образовывать соединения за счет только донорно-акцепторного взаимодействия: Так, нагреванием порошка железа в струе СО при температуре 150—200 °С и давлении около 1×107 — 2×107 Па образуется пентакарбонил железа Fе(СО)5: -
Fе + 5СO = Fе(СО)5
Пентакарбонил железа Fе(СО)5 — желтая летучая жидкость (Tпл. —20 °С, Tкип. 103 °С), растворимая в бензоле и эфире и нерастворимая в воде. Его молекула имеет конфигурацию тригональной бипирамидьт (рис. 2), т. е. соответствует dsр 3—гибридизации d-связывающих орбиталей атома железа:

| Рис. 2. Строение молекулы пентакарбонила железа Fе(СО)5 |
 Аналогично строение молекул пентакарбонилов рутения Ru(СО)5 (Tпл. —22 °С) и осмия Оs(СО)5 (Tпл. —15 °С), представляющих собой при обычных условиях бесцветные жидкости.
Аналогично строение молекул пентакарбонилов рутения Ru(СО)5 (Tпл. —22 °С) и осмия Оs(СО)5 (Tпл. —15 °С), представляющих собой при обычных условиях бесцветные жидкости.
 Получены также карбонилы железа в его аналогов более сложного состава; Так, при облучении Fе(СО)5 ультрафиолетовьим светом выделяется СО и образуются темно-желтые кристаллы эннеакарбонила Fе2(СО)9 (Tпл. 100 °С). Это двухъядерное соединение кластерного типа. В нем атомы железа связаны и непосредственно, и через СО-мостики:
Получены также карбонилы железа в его аналогов более сложного состава; Так, при облучении Fе(СО)5 ультрафиолетовьим светом выделяется СО и образуются темно-желтые кристаллы эннеакарбонила Fе2(СО)9 (Tпл. 100 °С). Это двухъядерное соединение кластерного типа. В нем атомы железа связаны и непосредственно, и через СО-мостики:
Кроме того, известны трехъядерные додекакарбонилы Э3(СО)12. В обычных условиях это твердые вещества зеленого Fе3(СО)12 (Tразл. 100 °С), Ru3(СО)12 и желтого Os3(СО)12 (Tпл. 224 °С) цвета.
При нагревании карбонилы разрушаются, что используется для получения чистейших металлов. Процесс получения и распада Fе(СО)5 можно представить схемой
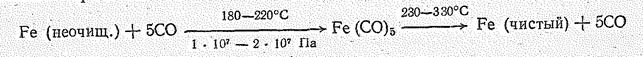 На первой стадии процесса СО избирательно реагирует с железо-содержащим сырьем с получением Fе(СО)5, при этом происходит значительная очистка от микропримесей других металлов. На второй стадии при термическом разложении карбонила образуются чистое железо и СО, который повторно используется в процессе.
На первой стадии процесса СО избирательно реагирует с железо-содержащим сырьем с получением Fе(СО)5, при этом происходит значительная очистка от микропримесей других металлов. На второй стадии при термическом разложении карбонила образуются чистое железо и СО, который повторно используется в процессе.
Карбонилы металлов могут окисляться и восстанавливаться частично или полностью, сохраняя координированные СО-группы. Так, в жидком аммиаке Ее(СО)е вэаимо1ействует с металлическим натр нем:
Fео(СО)5 + 2Nа = Nа2[Fе—2 (СО)4] + СО
а в спиртовом растворе — со щелочью:
Fе(СО)5 + 4КОН = К2[Fе(СО)4] + К2СО3 + 2Н2O
Соединения типа М+12[Fе(СО)4] являются солями. Они легко гидролизуются, образуя гидрокарбонил (карбонил-гидрид) Н2Fе(СО)4. Ион [Fе(СО)4]2- можно рассматривать как производное железа в степени окисления —2. В качестве производного железа в степени окисления —1 можно рассматривать ион [Fе2(СО)8]2-. Известны также Н2Ru(СО)4 и Н2Оs(СО)4. Производные типа М+2Fе(СО)4 (где М+2— d -элемент) представляют собой смешанные карбонилы двух металлов.
При осторожном окислении Fе(СО)5 галогенами одна из СО-групп замещается на два атома галогена:
Fео(СО)5 + I2 = [Fе+2 (СО)4]I2 + СО
Для Fе (0), Ru (0) и Оs (0) известны также нитрозилы Э(NO)4, нитрозилкарбонилы Э(СО)2(NО)2, соединения типа Fе(NО)2(РF3)2 и др.
Соединения Fе (II), Ru (II), Оs (II). Для железа (II) наиболее типично координационное число 6, что соответствует октаэдрическому расположению связей в комплексах и структурных единицах. Железо (II) шестикоординационно, например, в кристаллах FеО (структура типа NаСl), FеF2 (структура типа рутила), FеСl2 и в многочисленных комплексных ионах [Fе(ОН2)6]2+, [FеF6]4-, [Fе(СN)6]4- и др. Имеются также тетраэдрические комплексы типа FеСl42-, Fе(СNS)42-.
В водных растворах существуют катионные аквокомплексы [Fе(ОН2)6]2+, имеющие бледно-зеленую окраску. Гексааквокомплексы образуются при растворении в воде солей Fе (II) или при взаимодействии с разбавленными кислотами железа, оксида FеО (черный), гидрооксида Fе(ОН)2 (белый), сульфида FеS (черный), карбоната FеСО3 (белый), например:

Железо (II) образует соли почти со всеми анионами. При выпаривании из водных растворов обычно выделяются зеленые кристаллогидраты, например Fе(СlO4)2×6Н2O, Fе(NO3)2×6H2O, FеSO4×7Н2O, FеВr2×6Н2O, (NН4)2Fе(SO4)2×6Н2О (соль Мора).
Как и большинство других комплексов Fе (II), аквоион [Fе(ОН2)6]2+ парамагнитен, что соответствует следующей электронной конфигурации:

За счет потери одного p d -электрона ион [Fе(0Н2)6]2+ довольно легко окисляется до [Fе(OН2)6]3+:

Стандартный потенциал системы Fе3+ + е = Fе2+ равен 0,76 В, поэтому ион Fе может окисляться в кислой среде даже молекулярным кислородом:
2Fе2+ + 1/2 O2 + 2Н+ = 2Fе3+ + Н2O, Ео = 0,46 В
В присутствии влаги постепенно окисляются кислородом воздуха твердые FеСО3 и FеS, например:
4FеS + O2 + 10Н2O = 4Fе(ОН)3 + 4Н2S
Особо легко окисление идет в щелочной среде. Так, Fе(ОН)2 в момент получения тотчас начинает переходить в Fе(ОН)3, поэтому белый осадок быстро. темнеет:
4Fе(ОН)2 + O2 + 2Н2O = 4Fе(ОН)3
В аналитической практике для количественного определения Fе2+ используется реакция
5[Fе(OН2)6]2+ + МnO4- + 8OН3+ = 5[Fе(OН2)6]3+ + [Мn(OН2)6]2+ + 6Н2O
или
5Fe2+ + МnO4- + 8Н+ = 5Fе3+ + Мn2+ + 4Н2O
Из катионных комплексов Fе+2 (II) известны также амминокомплексы [Fе(NН3)6]2+. Аммиакаты образуются за счет взаимодействия аммиака с без- водными соединениями железа (II), например с его галогенидами. Аммиакаты устойчивы лишь в твердом состоянии и в насыщенных водных растворах аммиака. При растворении в воде аммиакаты Ее(II) легко разрушаются:
[Fе(NН3)6]Сl2 + 2Н2O «Fе(ОН)2 + 2NН4Сl + 4Н3N
Значительно более устойчивы в растворах хелатные амминокомплексы.
 Важнейшими хелатныими комплексами железа (II) являются так называ емые гемы:
Важнейшими хелатныими комплексами железа (II) являются так называ емые гемы:
Гемы входят в состав гемоглобина, выполняющего в организме функцию переносчика кислорода. Активным центром в процессе связывания кислорода является атом железа (II) гема. Процесс присоединения кислорода обратим; в легких, где парциальное давление кислорода высокое, молекула О2 присоединяется к атому железа, а в тканях, где парциальное давление кислорода низкое, кислород освобождается.
Производные анионных комплексов железа (II) ферраты (II)— в большинстве малостойки и напоминают двойные соли. К ним относятся, например, M+12[FеСl4] и M+12[Fе(SСN)4]. При кипячения (в восстановительной атмосфере) в концентрированных щелочах Fе(ОН)2 образует гексагидроксоферраты (II), например зеленые Nа4[Fе(OН)6], Bа2[Fе(ОН)6]. В воде гексагидроксоферраты (II) полностью разрушаются.
Для железа (II) наиболее устойчив и легко образуется цианидный комплекс [Fе(СN)6]4- (Кнест = 4×10-36):
6КСN + FеSO4 = К4[Fе(СN)6] + К2SО4
Этот ион диамагнитен:
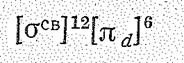
| 
|
Пи действии на гексацианоферраты (II) сильных кислот получается Н4[Fе(СN)6] — белый мелкокристаллический диамагнитный порошок, хорошо растворяется в воде, является весьма сильной (железистосинеродистой) кислотой.
Из цианоферратов (II) наиболее широко применяются К4[Fе(СN)6]×3Н2O (желтая кровяная соль). Гексацианоферрат (II) калия раньше получили сплавлением кровяных отбросов боен (в частности крови) с поташом и железными опилками, что дало ему название («желтой кровяной соли». В настоящее время исходным продуктом для получения служат цианистые соединения, выделяемые в качестве побочного продукта при сухой перегонке каменного угля.
Гексацианоферраты (II) d -элементов, например Сu2[Fе(СN)6], Fе2[Fе(СN)6], имеют координационную структуру. В. их кристаллах атомы Fе и соответствующего d-элемента связаны через СN-группы.
Таким образом, они представляют собой смешанные цианиды.
Многие из них имеют интенсивную окраску, в воде растворимы плохо. Желтая кровяная соль широко используется в аналитической практике для обнаружения ионов Fе3+:
FеСl3 + К4[Fе(СN)6] = КFе[Fе(СN)6] + 3КСl
или
Fе+3 + К+ + [Fе(СN)6)4- = КFе3+[Fе+2 (СN)6]
При этом образуется малорастворимый. смешанный цианоферрат (II) калия (I)-железа (III) интенсивно синего цвета. Это соединение часто называют берлинской лазурью.
Из производных рутения (II) и осмия (II) наиболее устойчивы комплексные цианиды типа M1+4[Э(CN)6].
Соединения Fе (III), Ru (III), Оs (III). Координационные числа Fе (III) равны 6 и 4, что соответствует октаэдрическому и тетраэдрическому расположению связей, Так, в кристаллическом FеСl3 железо шестикоординационно. При растворении FеСl3 в воде образуются октаэдрические комплексы [Fе(ОН2)6]3+. При растворении в неполярных растворителях (например, в СS2) или при возгонке образуются молекулы Fе2Сl6 (типа Аl2Сl6):
 В отличие от слоистого FеСl3 (Tпл. 308 °С, Tкип. 315 °С) трифторид железа FеF3, имеющий координационную решетку типа RеО3, тугоплавок (Tвозг. выше 1000 °С), в воде не растворяется, химически неактивен.
В отличие от слоистого FеСl3 (Tпл. 308 °С, Tкип. 315 °С) трифторид железа FеF3, имеющий координационную решетку типа RеО3, тугоплавок (Tвозг. выше 1000 °С), в воде не растворяется, химически неактивен.
Оксид Fе2О3 (от темно-красного до черного цвета) существует в виде трех модификаций, по структуре подобных Аl2O3. В кристаллах a-Fе2О3 (гемматит), как и в корунде, имеет место октаэдро-тетраэдрическаа координапия атомов. a-Fе2O3 парамагнитен, а g-Fе2О3 ферромагнитен.
Гидроксид Fе(ОН)3, получаемый в виде красно-коричневого осадка, имеет переменный состав Fе2О3×nН2О. При его обезвоживании образуются промежуточные оловые и оксоловые высокомолекулярные соединения состава FеООН (являющиеся основой ряда минералов железа) и, наконец, Fе2О3.
 Fе2O3 и Fе2О3×nН2О растворяются в кислотах, образуя светло- фиолетовые аквокомплексы [Fе(ОН2)6]3+. Из кислых растворов выделяются кристаллогидраты FеСl3× 6Н2O, Fе(NО3)3×6H2О, Fе(NО3)3×9Н2O, Fе(СlO4)3×10Н2O, M+1Fе(SО4)2×12Н2O (железные квасцы) в др. Безводные соединения имеют окраску, зависящую от природы аниона: FеF3 — зеленоватого, FеСl3 — черно-коричневого, Fе(SСN)3 — кроваво-красного цвета. В нейтральных раствор ах соли Fе (III) гидролизуются в заметной степени, при этом окраска растворов становится желто-коричневой. Начальные стадии гидролиза можно описать уравнениями:
Fе2O3 и Fе2О3×nН2О растворяются в кислотах, образуя светло- фиолетовые аквокомплексы [Fе(ОН2)6]3+. Из кислых растворов выделяются кристаллогидраты FеСl3× 6Н2O, Fе(NО3)3×6H2О, Fе(NО3)3×9Н2O, Fе(СlO4)3×10Н2O, M+1Fе(SО4)2×12Н2O (железные квасцы) в др. Безводные соединения имеют окраску, зависящую от природы аниона: FеF3 — зеленоватого, FеСl3 — черно-коричневого, Fе(SСN)3 — кроваво-красного цвета. В нейтральных раствор ах соли Fе (III) гидролизуются в заметной степени, при этом окраска растворов становится желто-коричневой. Начальные стадии гидролиза можно описать уравнениями:
 В результате последующей полимеризации гидроксоаквокомплексов (особенно при нагревании) образуются многоядерные комплексы, производные которых выделяются из растворов в коллоидном состоянии. В итоге выпадает Fе2O3×nН2О в виде красно-коричневой студенистой массы.
В результате последующей полимеризации гидроксоаквокомплексов (особенно при нагревании) образуются многоядерные комплексы, производные которых выделяются из растворов в коллоидном состоянии. В итоге выпадает Fе2O3×nН2О в виде красно-коричневой студенистой массы.
Аммиакаты Fе (III) типа [Fе(NН3)6]Наl3 менее устойчивы, чем аммиакаты Fе (II). Водой они полностью разлагаются.
Анионные комплексы Fе (III) устойчивее и легче образуются, чем таковые Fе (II). Так, свежеполученный Fе(ОН)3 (Fе2О3×nН2О) заметно растворяется в концентрированных щелочах, образуя гексагидроксофераты (III) типа М+13[Fе(ОН)6]. При сплавлении Fе2O3 или Fе(ОН)3 со щелочами или карбонатами щелочных металлов образуют полимерные оксоферраты (III) типа М+1FеО2, называемые ферритами:
Nа2СО3 + Fе2O3 = 2NаFеО2 + СО2
Оксо- и гидроксоферраты (III) s-элементов I и II групп (желтого или красного цвета) водой разрушаются.
В качестве оксометаферрата (III) железа (II) Fе+2 (FеO2)2 можно рассматривать смешанный оксид магнетит Fе3О4 (черного цвета).
В кристаллах магнетита атомы Fе (II) находится в октаэдрическом, а Fе (III) в октаэдрическом и тетраэдрическом окружении атомов кислорода. Аналогичную структуру имеют ферриты и других s-элементов.
Магнетит и ферриты М+2 (FeО2)2 (где М = Мn, Со, Ni, Сu) ферромагнитны. Их применяют в электротехнике, в частности в производстве магнитных звуковых лент.
 Кислотные свойства проявляют и другие соединения железа (II), которым соответствуют ферраты (III) типа М+13[FеF6], М+1[FеСl4], М+13[Fе(SСN)6] и др. Из анионных комплексов Fе (III) особо устойчив гексацианоферрат (III) [Fе(СN)6]3- (Кнест»10-44). В отличие от большинства других комплексов Fе(III), которые являются высокоспиновыми, этот ион — низкоспиновый комплекс: (sсв)12(p d)5. Его производные получают окислением гексацианоферратов (II). Наибольшее значение из цианоферратов (III) имеет К3[Fе(СN)6] (красная кровяная соль). Эта соль, в частности, является реактивом на ионы Fе2+, дает с ними интенсивно синий малорастворимый гексацианоферрат (III) калия (I)-железа (II) (турнбуллева синь):
Кислотные свойства проявляют и другие соединения железа (II), которым соответствуют ферраты (III) типа М+13[FеF6], М+1[FеСl4], М+13[Fе(SСN)6] и др. Из анионных комплексов Fе (III) особо устойчив гексацианоферрат (III) [Fе(СN)6]3- (Кнест»10-44). В отличие от большинства других комплексов Fе(III), которые являются высокоспиновыми, этот ион — низкоспиновый комплекс: (sсв)12(p d)5. Его производные получают окислением гексацианоферратов (II). Наибольшее значение из цианоферратов (III) имеет К3[Fе(СN)6] (красная кровяная соль). Эта соль, в частности, является реактивом на ионы Fе2+, дает с ними интенсивно синий малорастворимый гексацианоферрат (III) калия (I)-железа (II) (турнбуллева синь):
 или
или
Турнбуллева синь КFе2+[Fе3+(СN)6], берлинская лазурь КFе3+[Fе2+(СN)6].
Как показывают рентгеноструктурные исследования, турнбуллева синь и берлинская лазурь имеют одинаковую кубическую решетку с атомами железа в эквивалентных положениях. Показано также, что их g-резонансные спектры практически одинаковы. Все это свидетельствует о том, что турнбуллева синь и берлинская лазурь полностью идентичны и имеют формулу КFе[Fе(СN)6]. Атомы Fе (II) окружены атомами углерода, а атомы Fе (III) — атомами азота цианидных групп. Таким образом, КFе[Fе(СN)6] представляет собой соль, образованную полимерным координационным ионом [Fе2(СN)6]- со структурой, близкой к типу RеО3. В отличие от комплексных цианидов Fе(СN)3 неизвестен.
 Соединения Fе (III) проявляют окислительные свойства:
Соединения Fе (III) проявляют окислительные свойства:
Будучи окислителем, [Fе(СN)6]3- окисляет перекись водорода:

Вследствие окислительного действия Fе (III) неустойчивы FеI3 и Fе(СN)3. При попытке их получения в растворах происходит окислительно-восстановительная реакция, например:
2FеСl3 + 6КI = 2FеI2 + I2 + 6КСl
По этой же причине из растворов Fе (IП) осадить Fе2S3 не удается. При добавлении Н2S или сульфида к раствору Fе3+ образуется осадок, содержащий FеS и коллоидную серу.
Для рутения (III) и осмия (III) известны соединения типа M+13[Э(CN)6] и М+13[ЭСl6].
Соединения Fе (IV), Ru (IV), Оs (IV). Степень окисления +4 обычно проявляют рутений и осмий. Для них известны оксиды, галогениды и многочисленные производные анионных комплексов общей формулы М+12[ЭХ6], например М+12ЭСl, М+12[ЭСl3Вr3], М+12[ЭВr6].
Оксиды и гидроксиды Ru (IV) и Оs (IV) преимущественно кислотные соединения. Диоксиды ЭО2 (черного цвета) в воде не растворяются, но взаимодействуют с галогеноводородными кислотами
ЭО2 + 6НСl = Н2[ЭСl6] + 2Н2O
При гидролизе тетрагалогенидов образуются также анионные комплексы:
3ЭF4 + 2Н2O = ЭO2 + 2Н2[ЭF6]
Для железа (IV) известны оксоферраты (IV) типа М+2FeO3, М+12FеО3 и М+22FеО4. Это черные или темно-серые порошки, устойчивые при комнатной температуре и в отсутствие влаги. По строению они изотипны соответствующим оксотитанатам (IV). Оксоферраты (IV) — сильные окислители, например окисляют концентрированную соляную кислоту. Оксоферраты (IV) можно получить окислением оксоферратов (III) в токе кислорода при нагревании.
Соединения Fе (VI), Ru (VI), Оs (VI). Степень окисления +6 железа и рутения проявляется в тетраэдрических анионах типа ЭО42-, а осмия — в октаэдрическом [ОsО2(ОН)4]2-. Тетраоксоферраты (VI), тетраоксорутенаты (VI) и тетрагидроксодиоксоосматы (VI) образуются при окислении металлов или соответствующих соединений в сильнощелочной среде, например:
Fе2O3 + 3КNО3 + 4КОН ===== 2К2FеО4 + 3КNО2 + 2Н2О
сплавление
Оксоферраты (VI) — кристаллические вещества, обычно красного цвета. По структуре изоморфны соответствующим оксохроматам (VI) и оксосульфатам (VI), образуют с ними твердые растворы. По растворимости они также напоминают соответствующие хроматы и сульфаты. В частности, подобно оксохроматам и оксосульфатам, растворимы оксоферраты (VI) щелочных металлов и кальция; оксоферраты бария и стронция нерастворимы. В растворах и при небольшом нагревании большинство из них разлагается, выделяя кислород. Оксоферраты (VI) — сильные окислители, превосходящие в этом отношении оксоманганаты (VII). Например, окисляют Н3N до NO3-, Сr(OН)4- до Сr(OH)42-, АsО33- до АsO43- и т. д.
Окислительные свойства оксорутенатов (VI) (оранжевого цвета) выражены -менее отчетливо, но все же они окисляют концентрированную соляную кислоту. В соответствии с устойчивой степенью окисления осмия гидроксодиоксоосматы (VI) (розового цвета), наоборот, довольно легко окисляются до OsO4-;
2К2[OsO2(ОН)4] + O2 = 2OsO4 + 4КОН + 2Н2O
Соединения типа Н2ЭO4 (железная, рутаениевая, осмиевая кислоты) и ЭO3 не получены: при действии кислот оксоферраты (VI), оксорутенаты (VI) и гидроксооксоосматы (VI) разлагаются, например:
2Na2RuO4 + 2Н2SО4 = 2Nа2SО4 + 2RuО2 + O2 + 2Н2О
Получены также рутенаты (VI) и осматы (VI) следующих типов: М+12[ЭО2Наl4], M+12[ОsNНаl5].
Из бинарных соединений Э (VI) известны лишь гексафториды: RuF6 (коричневого цвета, Tпл. 54 °С) и ОsF6 (желто-зеленый, Тпл. 33,2 °С). Гексафториды очень реакционноспособны, легко распадаются на фтор и низшие фториды.
Соединения Ru (VIII) и Os (VIII). Для рутения и осмия известны тетраоксиды. Они имеют молекулярную решетку, состоящую из тетраэдрических молекул ЭО4. Поэтому - тетраоксиды легкоплавки (Тпл. 30-40 оС), летучи. RuО4 оранжево-желтый, а OsO4 — бесцветный. Молекулы ЭО4 имеют следующую электронную конфигурацию (без учета 2 s -электронов кислорода):

Тетраоксид рутения получают окислением рутенатов (VI):
Nа2RuO4 + Сl2 = RuO4 + 2NаСl
Тетраоксид осмия довольно легко образуется при окислении осмия или его соединений кислородом, азотной кислотой и другими. окислителями. OsO4 умеренно растворим в воде, но определенных соединений при этом не образует. Кислотные свойства OsO4 проявляет при взаимодействии с основными - соединениями: с концентрированными щелочами дает осматы (VIII) типа М+12[OsO4(ОН)2] (от желтого до коричневого цвета), с фторидами щелочных металлов — М+12[OsO4F2] (красно-коричневого цвета):
OsO4 + 2КОН = К2[OsO4(ОН)2]; OsO4 + 2КF = К2[OsO4F2]
При одновременном действии на OsO4 концентрированного КОН и Н3N образуется осмат типа К[ОsО3N] (желтые кристаллы):
OsO4 + КОН + Н3N = К[ОsО3N] + 2Н2O
Известны и другие типы осматов (VIII). Рутенаты (VIII) неустойчивы. В щелочах RuO4 растворяется, выделяя кислород:
2RuO4 + 4NаОН = 2Nа2RuО4 + O2 + 2H2О
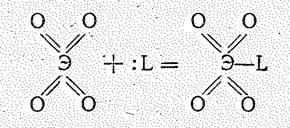 ЭO4 способны присоединять молекулы-доноры электронных - пар L:
ЭO4 способны присоединять молекулы-доноры электронных - пар L:
Например, взаимодействие OsO4 с жидким Н3N приводит к образованию летучего OsO4×NН3; более устойчивы соединения типа RuO4×РR3 (где R = F или органический лиганд). При протекании этих реакций Ru и Os переходят в девятивалентное состояние.
RuО4 — сильный окислитель: окисляет концентрированную соляную кислоту, со спиртами взрывает, при нагревании взрывает распадаясь на RuO2 и кислород.
Тетраоксид железа FеO4 (изоэлектронный VO43-, СrО42-. и МnO4-) не получен, так как имеет очень большое сродство к электрону и переходит в ион FеO42-.
Тетраоксиды осмия и рутения ядовиты. OsO4 по запаху напоминает хлор, а RuO4 озон. OsO4 наиболее часто применяемое соединение осмия. Его используют как мягкий окислитель и катализатор в органическом синтезе (например, кортизона) и для подкрашивания животных тканей при их микроскопическом исследовании.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1838; Нарушение авторских прав?; Мы поможем в написании вашей работы!