
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ol — V2X 17 страница
|
|
|
|
Ho^Tlncoi-f-ifri+CoiPii.
ро2 = Г lnc02-f TJ?2-(-c02R22,
где pot, рог—химические потенциалы чистых растворяемых веществ. Совместные же растворимости с'п, с'о2 определяются условиями
Poi = 7'lncoi + i|)1+CoiP11+Co2pi2,
\io2 = T 1псо2-г"ф2 + со2Р22 + С|)]Р12.
Вычитая (1) почленно из (2) и имея в виду относительную малость изменений растворимостей (бс01 =coi—с01<^с01, 8с02<^с02), находим
Т ——=—с02р12, Т——- = — c0lPi2.
••01 с02
Отсюда
т. е. изменения растворимостей обоих веществ одинаковы.
3. Найти связь между изменениями давления насыщенных паров двух растворенных веществ в присутствии друг друга.
Решение. Давления насыщенных паров над растворами каждого из веществ в отдельности определяются условиями равновесия
Т InPi + Xi (Т) = Т InCi + ^+CjPn, Т In Р2 + х2 (Г) = Г In с2 +12+с2р22 (выражения слева — химические потенциалы обоих веществ в паре). Давления же Р\ и Р2 над совместным раствором — из условий
Т In р[ + xi = Т In d + ifc + Clpu+c2p12, Г In P2+Xs = Г Ь c2 + ^2 + c2p22 + Clp„. Отсюда для малых изменений 6Р1 = Р[—Plt SP2 находим
Т -p^-=c2Pi2, Т -р^-=с1р12,
и затем искомое соотношение
№t.8P, с,
§ 91. Выделение тепла и изменение объема при растворении
Процесс растворения сопровождается выделением или поглощением тепла; мы займемся теперь вычислением этого теплового эффекта. Предварительно определим максимальную работу, которая может быть совершена за счет процесса растворения.
Предположим, что процесс растворения производится при постоянных давлении и температуре. В таком случае максимальная работа определяется изменением термодинамического потенциала. Вычислим ее для процесса, при котором в растворе концентрации с растворяется еще некоторое небольшое число б/г молекул растворяемого вещества. Изменение полного термодинамического потенциала всей системы 6Ф равно сумме изменений потенциала раствора и чистого растворяемого вещества. Поскольку к раствору добавляется б/г молекул растворенного вещества, то изменение его термодинамического потенциала есть
бФрасг = ^Г"Тб/г = р,'бп,
где и.'—химический потенциал растворенного вещества в растворе. Изменение потенциала Ф0 чистого растворяемого вещества равно
6Ф0 = — ~ б/г = — ьцб/г,
так как число его молекул уменьшается на б/г (р.0—химический потенциал чистого растворяемого вещества). Следовательно, полное изменение термодинамического потенциала при рассматриваемом процессе равно
бФ = бп(ц' —цо). (91,1)
Подставив сюда и.' из (87,5), получим
6Ф = — Т б/г 1пс°(Р; Т), (91,2)
где величина
с0(Р, Т) = е т (91,3)
есть растворимость, т. е. концентрация насыщенного раствора (раствора, находящегося в равновесии с чистым растворяемым веществом). Это ясно из того, что в равновесии Ф должно иметь минимум, т.е. должно быть 6Ф = 0. Формулу (91,3) можно получить и непосредственно из условия равновесия раствора с чистым растворяемым веществом, т. е. из равенства химических потенциалов растворяемого вещества—чистого и в растворе (следует, однако, заметить, что с0 может быть отождествлено с концентрацией насыщенного раствора только в том случае, если с0 мало, так как все формулы последних параграфов применимы только к малым концентрациям).
Полученное выражение определяет искомую работу: величина | 6Ф | есть максимальная работа, которая может быть совершена за счет растворения б/г молекул; эта же величина есть минимальная работа, которую необходимо затратить для того, чтобы из раствора концентрации с выделить бя молекул растворенного вещества.
Теперь уже не представляет труда вычислить поглощение тепла 8QP при растворении при постоянном давлении (если 8QP < 0, то это значит, что тепло выделяется). Количество тепла, поглощающееся при процессе, происходящем при постоянном давлении, равно изменению тепловой функции (§ 14). Поскольку, с другой стороны,
\дТ Т,
то имеем1)
ЩР = -Т*(Щр. (91,4)
Подставляя в эту формулу выражение (91,2), найдем искомое количество тепла
SQP= ТЧпЩ^-. (91,5)
Таким образом, тепловой эффект растворения связан с зависимостью растворимости от температуры. Мы видим, что 8Qp просто пропорционально бя; поэтому эта формула применима и к растворению любого конечного количества вещества (до тех пор, разумеется, пока раствор слабый). Количество тепла, поглощающееся при растворении я молекул, равно
Qp = nT2^pL. (91,6)
Определим еще изменение объема при растворении, т. е. разность между объемом раствора и суммой объемов чистого растворяемого вещества и растворителя, в котором оно растворяется. Вычислим это изменение SV для растворения бя молекул. Объем есть производная от термодинамического потенциала по давлению. Поэтому изменение объема равно производной по давлению от изменения термодинамического потенциала:
&У = §р8Ф. (91,7)
Подставляя 6Ф из (91,2), находим
SV = —T6n^lnc9. (91,8)
В заключение заметим, что формула (91,6) находится в соответствии с принципом Ле-Шателье. Предположим, например, что
г) Аналогичная формула для количества тепла- при процессе, происходящем при постоянном объеме:
Wv=-t*{wt)v- (91'4а>
Qp отрицательно, т. е. при растворении тепло выделяется. Рассмотрим насыщенный раствор; если его охладить, то, согласно принципу Ле-Шателье, растворимость должна повыситься так, чтобы произошло дальнейшее растворение. При этом выделится тепло, т. е. система как бы противодействует выводящему ее из равновесия охлаждению. То же самое следует и из (91,6), так как в данном случае дс„/дТ отрицательно. Аналогичные рассуждения доказывают согласие с принципом Ле-Шателье и формулы (91,8).
Задачи
1. Найти максимальную работу, которая может быть произведена при об-
разовании насыщенного раствора.
Решение. До растворения термодинамический потенциал чистого растворителя был N\i0, а чистого растворяемого вещества пц'о. Потенциал всей системы был <!>! = N\i0 + п\хо. После растворения термодинамический потенциал
будет Фг = Л^0 + пГ In ^-{-nty. Максимальная работа
Rm» = <tf1-Oi=-nTln^+n(Vi-^)=nT ln^b
(эту величину можно получить и интегрированием выражения (91,2)). Если образуется насыщенный раствор, т. е. с = с0 и n = Nc=Nc0, то
Rmx = nT = Nc,T.
2. Найти минимальную работу, которую нужно произвести для того, чтобы,
выделив из раствора с концентрацией сг часть растворителя, довести его кон-
центрацию до с2.
Решение. До выделения термодинамический потенциал раствора был
Ф1 = Л?(х0 + Л?с1Г In ^-+Nc^
(число молекул растворенного вещества было Ncj; N—первоначальное число молекул растворителя). Для того чтобы довести концентрацию раствора до с2, надо выделить из него N (1—Ci/c2) молекул растворителя. Сумма термодинамических потенциалов оставшегося раствора и выделенного растворителя дает
Ф2 = NyL0 + Ncj In ^- + Ncrf.
Минимальная работа
/?„,„=ф1-ф1=л?с1г in h..
ci
§ 92. Растворы сильных электролитов
Метод разложения термодинамических величин по степеням концентрации, использованный в предыдущих параграфах, совершенно непригоден в важном случае растворов сильных электролитов, т. е. веществ, которые при растворении почти нацело диссоциируют на ионы. Медленное убывание кулоновских сил взаимодействия между ионами с увеличением расстояния приводит к появлению членов, пропорциональных концентрации в степени более низкой, чем вторая (фактически—степени 3/2).
Легко видеть, что задача об определении термодинамических величин слабого раствора сильного электролита сводится к рассмотренной в § 78 задаче о полностью ионизованном газе (P. Debye, Е. Hiickel, 1923). В этом можно убедиться, отправляясь от основной статистической формулы для свободной энергии (31,5). Будем производить интегрирование в статистическом интеграле в два этапа. Сначала проинтегрируем по координатам и импульсам молекул растворителя. Тогда статистический интеграл примет вид
где интегрирование распространяется теперь только по фазовому пространству частиц электролита, a F (р, q) есть свободная энергия растворителя с «вставленными» в него ионами, координаты и импульсы которых играют роль параметров. Как известно из электродинамики, свободная энергия системы зарядов в среде (при заданных объеме и температуре последней) получается из энергии зарядов в пустом пространстве делением произведений каждых двух зарядов на диэлектрическую постоянную среды е1). Поэтому второй этап вычисления свободной энергии раствора совпадает с вычислениями, произведенными в § 78.
Таким образом, искомый вклад сильного электролита в свободную энергию раствора дается, согласно (78,12), выражением
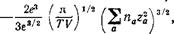
где суммирование производится по всем сортам ионов в растворе; в соответствии с обозначениями в этой главе посредством па обозначается полное число ионов сорта а (во всем объеме раствора). Этим же выражением определяется вклад в термодинамический потенциал, рассматриваемый при заданных температуре и давлении. Вводя молекулярный объем растворителя v(P, Т) посредством V«Nv, напишем термодинамический потенциал раствора в виде
ф.^+х („.г +м,) (£ г * (
| 1) Это утверждение подразумевает, что расстояния между ионами велики по сравнению с молекулярными размерами. Но мы знаем из § 78, что в рассматриваемом приближении основной вклад в термодинамические величины происходит именно с этих расстояний. |
' ''(92,1)
По обычным правилам отсюда можно найти любые термодинамические свойства раствора электролита.
Так, для вычисления осмотического давления пишем химический потенциал растворителя:
Подобно тому, как это было сделано в § 88, находим отсюда осмотическое давление (на границе с чистым растворителем):
A^=TL^—^m{t} ' (92>3)
Тепловая функция раствора: д Ф'
W-------- Т2\дТТ Jp
(92,4)
Отсюда можно найти теплоту растворения Q, выделяющуюся при разведении раствора (при постоянных Р и Т) очень большим количеством растворителя (так что концентрация стремится к нулю). Это количество тепла дается изменением тепловой функции при процессе. Линейные по числу частиц члены, очевидно, выпадают из соответствующей разности, и мы находим из (92,4)
Единственное условие применимости полученных формул состоит в требовании достаточной малости концентрации. Действительно, тот факт, что электролит является сильным, означает, что энергия притяжения между ионами различного сорта всегда меньше Т. Отсюда следует, что энергия взаимодействия будет во всяком случае мала по сравнению с Г на расстояниях, больших по сравнению с молекулярными. Между тем условие слабости раствора (n<^.N) означает именно, что среднее расстояние между ионами велико по сравнению с молекулярными размерами. Поэтому из этого условия автоматически следует соблюдение условия слабости взаимодействия, выражаемого неравенством
(ср. (78,2)) и лежащего в основе принятых в § 78 приближений.
Задача
Найти изменение растворимости сильного электролита (которая предполагается малой) при добавлении в раствор определенного количества другого электролита (причем все ионы последнего отличны от ионов основного электролита).
Решение. Растворимость (т. е. концентрация насыщенного раствора) сильного электролита определяется уравнением
Здесь u,TB—химический потенциал чистого твердого электролита, a va—число ионов сорта а в одной молекуле электролита. При добавлении к раствору посторонних ионов химические потенциалы собственных ионов изменятся благодаря изменению суммы 2n6zl>> в К0Т0РУЮ должны быть включены все присутствующие в растворе ионы. Определив растворимость с0 посредством naIN = = vac0, мы найдем ее изменение путем варьирования выражения (1) при заданных Р и Т:
Сумма под знаком вариации включает в себя только ионы добавленных сортов-Обратим внимание на то, что в рассмотренных условиях растворимость повышается.
§ 93. Смесь идеальных газов
Аддитивность термодинамических величин (таких, как энергия, энтропия и т. п.) имеет место лишь постольку, поскольку можно пренебречь взаимодействием отдельных частей тела. Поэтому для смеси нескольких веществ — например смеси нескольких жидкостей — термодинамические величины не будут равны суммам термодинамических величин отдельных компонент смеси.
Исключение представляет смесь идеальных газов, так как взаимодействием их молекул можно по определению пренебречь. Энтропия, например, такой смеси равна сумме энтропии каждого из входящих в состав смеси газов, как если бы других газов не было, а каждый из газов имел бы объем, равный объему всей смеси, и, следовательно, давление, равное парциальному давлению данного газа в смеси. Парциальное давление i-ro газа Р{ выражается через.давление Р всей смеси следующим образом:
где N — полное число молекул в смеси, a N{—число молекул i-ro газа. Поэтому согласно (42,7) энтропия смеси двух газов равна
S = N1\n%- + N2 In ^-NJi (T)-NJ', (T), (93,2)
или, согласно (42,8),
S = - JVt In Р, - N2 In Р2 - N1%[(Т) - Ni%2(T) =
^-(N^N^lnP-NAn^—NJn^—N^m-N^iT).
(93,3)
Свободная энергия смеси равна, согласно (42,4),
F = — N1T ln-^-—N2T In ^щЛ-NJ,(T) + NJ2 (Г). (93,4)
Аналогично для потенциала Ф находим с помощью (42,6) Ф = NJ In Рг + N2T In Р2 + NlXl (Т) + N2%2 (Т) =
= N,(Т In Р + Xl) + N2 (ТIn Р +Ъ) + N,T In 4- + N2T In.
(93,5)
Из этого выражения видно, что химические потенциалы обоих газов в смеси:
рх = ТInP1+Xl = ТШР+Ъ + ТIn4",
VLt = T\nPt+%t = TlnP + %t + Tln^-,
т. е. каждый из них имеет такой же вид, какой имел бы химический потенциал чистого газа с давлением Рх или Р2.
Отметим, что свободная энергия смеси газов (93,4) имеет вид
F = F1(NU V, Т) + F2(N2,V, Т),
где Flt F2—свободные энергии первого и второго газов как функции числа частиц, объема и температуры; для термодинамического же потенциала аналогичное равенство не справедливо—потенциал Ф смеси имеет вид
Ф = Фг (Nlt Р,Т)+Ф2 (.ЛГ2, Р, Т) + NJ In -^L + N2T In.
Предположим, что мы имеем два различных газа с числами частиц iVj и N2, находящихся в сосудах с объемами Vx и V2, с одинаковыми температурами и одинаковыми давлениями. Затем оба сосуда соединяются и газы смешиваются, причем объем смеси делается равным Vj + Vsj, а давление и температура остаются, очевидно, прежними. Энтропия, однако, при этом меняется; действительно, до смешения энтропия обоих газов, равная сумме их энтропии, была
So = N, Inе^ + Ns In ^ - NJi (Т) - ВД (Т).
После смешения энтропия согласна (93,2) есть
5 = Nx In (Vt + Vt) + N2\n-^- (V, + V2) - Njl - ВД. Изменение энтропии
'1 У 2
или, поскольку при одинаковых давлениях и температурах объемы пропорциональны числу частиц:
AS = NAn-^- + N2ln~. (93,7)
Эта величина положительна, т. е. энтропия при смешении увеличивается, как и должно было быть ввиду очевидной необратимости процесса. Величину AS называют энтропией смешения.
Если бы оба газа были одинаковы, то энтропия после соединения сосудов была бы
S = (Nl + Ni) In I^-iN, + N,)f.
v, + v2 vt v2. и поскольку N ^N ~W~=~Fr(B СИЛУ Равенства давлении и температур), изменение энтропии было бы равно нулю.
Таким образом, изменение энтропии при смешении связано именно с различием молекул смешиваемых газов. Это соответствует тому, что необходимо затратить некоторую работу, для того чтобы отделить обратно молекулы одного газа от молекул другого.
§ 94. Смесь изотопов
Своеобразными «растворами» являются смеси различных изотопов (в любом агрегатном состоянии). Мы будем ниже говорить для простоты и определенности о смеси двух изотопов какого-либо элемента, хотя те же результаты относятся и к смеси любого числа изотопов, а также к сложным веществам (химическим соединениям), различные молекулы которых содержат различные изотопы.
В классической механике различие между частицами изотопов сводится к различию в их массах; законы же взаимодействия атомов изотопов совершенно одинаковы. Это обстоятельство позволяет весьма просто выразить термодинамические величины смеси через термодинамические величины чистых изотопов. При вычислении статистического интеграла смеси отличие сводится в основном к тому, что приходится делить элемент фазового объема не на N1,
как у чистого вещества, а на произведение JVX! Nt\ факториалов чисел частиц обеих компонент смеси. Это приводит к появлению в свободной энергии лишних членов
N,T In ^-+N2T In 4f-
(где N — А/г + N2), соответствующих энтропии смешения, о которой в случае смеси газов шла речь в § 93.
Такие же члены появятся и в термодинамическом потенциале смеси, который может быть написан в виде
Ф = NJ In + NJ In 4г + Л^о! + ЛГ2цоа. (94,1)
Здесь ц.01, р02 —химические потенциалы каждого из чистых изотопов; они отличаются друг от друга только пропорциональным температуре членом:
(хв1-11и=-|-Г1п-^., (94,2)
где т1, тг—массы атомов обоих изотопов (эта разница возникает при интегрировании в статистическом интеграле по импульсам атомов; в случае газов (94,2) есть просто умноженная на Т разность химических постоянных).
Разность (94,2) одинакова для всех фаз данного вещества. Поэтому уравнение фазового равновесия (условие равенства химических потенциалов фаз) для различных изотопов оказывается одинаковым. В частности, можно утверждать, что в классическом приближении упругости насыщенных паров различных чистых изотопов одинаковы.
Так просто обстоит дело лишь постольку, поскольку вещество может быть описано с помощью классической статистики. В квантовой же теории различие между изотопами становится значительно более глубоким в связи с различием колебательных и вращательных уровней молекул, различием ядерных спинов и т. п.
Существенно, однако, что и при учете первых поправочных членов в термодинамических величинах (члены порядка Й2; см. § 33) термодинамический потенциал смеси может быть написан в виде (94,1). Действительно, эти члены имеют вид суммы, причем каждое из слагаемых содержит массу лишь одного из атомов (см. формулу (33,15) для свободной энергии). Поэтому эти слагаемые можно сгруппировать так, чтобы включить в химические потенциалы ц01 и ц02; в результате формула (94,1) (но, разумеется, не (94,2)) останется в силе.
Обратим внимание на то, что термодинамический потенциал (94,1) имеет формально такой же вид, как для смеси двух произвольных газов (§ 93). Смеси, обладающие этим свойством, называют идеальными. Таким образом, смеси изотопов являются идеальными с точностью до членов порядка %2 включительно. В этом смысле смеси изотопов представляют собой исключительный случай, так как конденсированные смеси различных веществ (не изотопов) могут быть идеальными лишь в весьма грубом приближении.
В пределах применимости формулы (94,1) можно сделать определенные заключения об упругости паров изотопов над их конденсированной смесью. Химические потенциалы обеих компонент этой смеси равны
ц^Пп^-f u.OI, pa = Tlncs + Lioa
(где c^NjN, c2 = N2lN—концентрации изотопов). Приравнивая их химическим потенциалам в газообразной фазе (имеющим вид Т In Р1 + Xi (Т) и Т In Р2 + %2 (Т)), найдем для парциальных упру-гостей пара
Л = Л,А, Рш = Р0Лс„ (94,3)
где Р01 и Р02 обозначают упругости пара каждого из чистых изотопов (при данной температуре). Таким образом, парциальные упругости пара обоих изотопов пропорциональны их концентрациям в конденсированной смеси.
Что касается упругостей насыщенного пара чистых изотопов, то, как уже было указано, в классическом приближении Р01 = Р112. При учете же квантовых эффектов появляется различие между ними. Оно не может быть вычислено в общем виде для любых веществ. Такое вычисление может быть сделано лишь для одноатомных элементов (благородные газы) с точностью до членов порядка fa (К- Herzfeld, Е. Teller, 1938).
Поправка к термодинамическому потенциалу жидкой фазы определяется формулой (33,15) *); относя его к одному атому, найдем химический потенциал
М-И-кл-т- 24тГ г,
| *) Снова пользуемся тем, что малые добавки к различным термодинамическим потенциалам, будучи выражены через соответствующие переменные, равны друг другу (§ 15). |
где Т*—средний квадрат силы, действующей в жидкости на один атом со стороны остальных атомов. Химический же потенциал газа остается равным своему классическому выражению, так как взаимодействием частиц (атомов) газа можно пренебречь. Приравнивая химические потенциалы жидкости и газа, найдем поправку
к классическому значению упругости пара, а интересующая нас разность упругостей пара двух изотопов окажется равной
рм—р«* = ро-Ш*{щ — щ)> (94>4)
где Р0—общее классическое значение Poi и Р02. Мы видим, что знак этой разности определяется разностью обратных значений масс атомов изотопов, причем упругость паров легкого изотопа больше, чем у тяжелого.
§ 95. Давление пара над концентрированным раствором
Рассмотрим равновесие раствора с находящимся над ним паром, который состоит, вообще говоря, также из обоих веществ. При этом раствор может быть как слабым, так и сильным, т. е. количества обоих веществ в нем могут быть произвольными. Напомним, что результаты, полученные в § 89, относились только к слабым растворам.
Поскольку раствор и пар находятся в равновесии друг с другом, химические потенциалы рх и р2 обеих компонент в растворе и в паре равны друг другу. Если обозначить количества частиц обоих веществ в растворе через Щ и N$, то можно написать для раствора выражение (24,14) в виде
dQ = — Щ dp х—Щ dp 2—Sp dT — Р dVp. (95,1)
Здесь Sp и Vp—энтропия и объем раствора; температура Т и давление Р одинаковы для раствора и для пара.
Предположим, что пар над раствором настолько разрежен, что может рассматриваться как идеальный газ; давление его мало. На этом основании пренебрегаем в (95,1) членами, пропорциональными Р, т. е. Р dV и dQ. Будем сначала рассматривать все производные при постоянной температуре. Тогда получаем из (95,1)
JVPdp^ + A^dp^O. (95,2)
С другой стороны, для газообразной фазы
Vi = ThiPl + x1(T),
М = Т\пР,+х, (Г).
Здесь Р1 и Рг — парциальные давления обеих компонент пара. Дифференцируя эти выражения (при Т = const), находим
d\il = Td\nPlt dpr = rdlnP2.
Подставляя это в (95,2), получаем
NfdlnP1 + NtdlnP, = 0. (95,3)
растворы
[ГЛ. IX
Введем концентрацию £ раствора как отношение числа частиц первой компоненты к полному числу частиц:
и аналогично—концентрацию х пара. Парциальные давления Рх и Р2 равны произведениям полного давления Р пара на концентрации соответствующих компонент, т. е. Pt = xP, Р2 = (1—х) Р. Подставляя все это в (95,3) и деля это уравнение на полное число Ы = Щ-\-Щ частиц в растворе, находим
Id In Рх+ (1 — I) d In Р (1 — х) = 0,
откуда
d\nP= *~l,dx,
х(1 — х) '
или
| = *_*((95,4)
Это уравнение связывает концентрации раствора и пара с зависимостью упругости пара от его концентрации.
Еще одно общее соотношение можно получить, рассматривая температурную зависимость величин. Напишем условие равенства химических потенциалов в паре и растворе для одной из компонент, скажем первой:
г_ с7Фр ^ ~ dNl '
Разделив обе стороны равенства на Т и помня, что производная по числу частиц берется при постоянной температуре, пишем:
Ц а Фр Т dNl Т
Возьмем теперь от обеих сторон равенства полную производную по температуре. При этом можно с достаточной точностью считать, что термодинамический потенциал конденсированной фазы (раствора) не зависит от давления. Замечая также, что частная производная по температуре
дт т — Т2 \ дТ) Г»'
получим следующее соотношение:
ainP^ = г_а^р_ (95,5)
дТ
Здесь w{—молекулярная тепловая функция газа первого вещества; производная же dWpJdNp определяет изменение тепловой функции раствора при добавлении к нему одной молекулы этого вещества. Величина, стоящая в правой стороне равенства (95,5), представляет собой, следовательно, тепло, поглощающееся при переходе из раствора в пар одной частицы первого вещества.
Для чистого первого вещества соотношение (95,5) превращается в обычное уравнение Клапейрона — Клаузиуса
где Р10—упругость пара первого чистого вещества, a»f—его молекулярная тепловая функция в жидком состоянии. Вычитая это равенство почленно из уравнения (95,5), получим окончательно следующее соотношение:
где Oj = — wf—молекулярная теплота разбавления—количество тепла, поглощающееся при переходе в раствор одной частицы из жидкого первого вещества. Такое же соотношение можно, разумеется, написать и для второго вещества.
§ 96. Термодинамические неравенства в растворах
В § 21 было показано, что тело может существовать лишь в таких состояниях, в которых выполняются определенные условия—так называемые термодинамические неравенства. Эти условия были, однако, выведены нами для тел, состоящих из одинаковых частиц. Произведем теперь аналогичное исследование для растворов, причем мы ограничимся случаем смеси всего двух веществ. •
В § 21 мы пользовались в качестве условия равновесия не максимальностью энтропии замкнутого тела в целом, а эквивалентным ему условием, требующим положительности минимальной работы, необходимой для того, чтобы вывести какую-либо малую часть тела из состояния равновесия в любое другое близкое состояние.
Аналогично поступим и теперь. Выделим из раствора некоторую малую часть; числа частиц растворителя и растворенного вещества в ней пусть будут Nun. В состоянии равновесия температура, давление и концентрация в этой части равны значениям тех же величин для остального раствора (играющего роль внешней среды). Определим минимальную работу, которую необходимо произвести для того, чтобы выделенная нами часть, содержащая определенное число N частиц растворителя, приобрела температуру, давление и число частиц растворенного вещества, отличающиеся на малые (но конечные) величины 67, 6Р и 8п от их равновесных значений.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 345; Нарушение авторских прав?; Мы поможем в написании вашей работы!