
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ol — V2X 14 страница
|
|
|
|
Имея в виду, что согласно определению (75,3) dl/дц = ЦТ, получим
Л^Х-^гЕ». (75,6)
Два уравнения (75,4) и (75,6) определяют в параметрическом виде (параметр |) связь между Р, V и Т, т. е. уравнение состояния газа. Исключая из них £, можно получить уравнение состояния в виде ряда (75,1) с любым желаемым числом членов1).
§ 76. Формула ван-дер Ваальса
В газах взаимодействие между молекулами весьма слабо. По мере его усиления свойства газа все больше отклоняются от свойств идеальных газов, и в конце концов газ переходит в конденсированное тело—жидкость. В последней взаимодействие между молекулами велико, и свойства этого взаимодействия (а потому и свойства жидкости) сильно зависят от конкретного рода
х) В первом приближении Р=Т1, N = V\, откуда Р = NTJV=РНд- Во втором приближении
| NT N2T V 2V2 2* |
исключая из этих равенств £ (с той же точностью), получим что совпадает с (74,6).
жидкости. По этой причине невозможно, как уже указывалось, установить какие-либо общие формулы, которые бы количественно описывали свойства жидкости.
Можно, однако, найти некоторую интерполяционную формулу, качественно описывающую переход между жидкостью и газом. Эта формула должна давать правильные результаты в двух предельных случаях. Для разреженных газов она должна переходить в формулы, справедливые для идеальных газов. При увеличении же плотности, когда газ приближается к жидкости, она должна учитывать ограниченную сжимаемость вещества. Такая формула будет тогда качественно описывать поведение газа и в промежуточной области.
Для вывода такой формулы исследуем более подробно отклонение от идеальности при высоких температурах. Как и в предыдущих параграфах, будем сначала рассматривать одноатомный газ; по тем же соображениям, что и ранее, все получающиеся формулы будут в равной степени применимы и к многоатомным газам.
Описанный в § 74 характер взаимодействия атомов газа (рис. 11) позволяет определить вид первых членов разложения В (Т) по степеням обратной температуры; при этом мы будем считать малым отношение
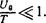
(76Д)
Имея в виду, что ига есть функция только расстояния г между атомами, пишем в интеграле (74,5) dV = 4nr'dr. Разбивая область интегрирования по dr на две части, пишем:
 В(Т) = 2пJ(1 —е~и
В(Т) = 2пJ(1 —е~и
о
»'т)г*dr + 2пI(1 — е~и^т) г*dr.
Но при значениях г между О и 2г0 потенциальная энергия Ult в общем очень велика. Поэтому в первом интеграле можно пренебречь членом ехр(—U12/T) по сравнению с единицей. Тогда этот интеграл становится равным положительной величине Ь — 16лгЦЗ (если для одноатомного газа рассматривать г0 как радиус атома, то Ь есть его учетверенный объем). Во втором интеграле везде (1/1а|/Г<(7в/Г<^1. Поэтому можно разложить подынтегральное выражение в нем по степеням U\JT, ограничившись первым неисчезающим членом. Тогда второй интеграл становится равным
-£S l«/i.l'e*-~
2а Т 1
где а—положительная постоянная. Таким образом, находим, что
В(Т) = Ь^-± (76,2)
Подставив это выражение в (74,4) и (74,7), находим свободную энергию газа
F = F„ + -^-(bT-a) (76,3)
и его термодинамический потенциал
<D = a>M + Jv7>(ft-f). (76,4)
Искомую интерполяционную формулу можно получить из формулы (76,3), которая сама по себе не удовлетворяет необходимым условиям, так как не учитывает ограниченную сжимаемость вещества. Подставим в (76,3) выражение для рия из (42,4). Мы получим тогда
F = Nf(T)—JVTln-^-—NT (inV—у-) • (76,5)
При выводе формулы (74,4) для свободной энергии газа мы предполагали, что газ, хотя и недостаточно разрежен для того, чтобы считаться идеальным, однако все же имеет достаточно большой объем (так, чтобы можно было пренебречь тройными и т. д. столкновениями молекул), т. е. расстояния между молекулами в общем значительно больше, чем их размеры. Можно сказать, что объем V газа во всяком случае значительно больше чем Nb. Поэтому
}n(V-Nb) = lnV + \n(l-y.)»taV—^. Следовательно, (76,5) можно написать в виде F^Nfi^ — NTln-^-iV—Nb)—^ =
= ^-iVTln(l-f)-^. (76,6)
В таком виде эта формула удовлетворяет поставленным выше условиям, так как при больших V она переходит в формулу для свободной внергии идеального газа, а при малых V она обнаруживает невозможность беспредельного сжатия газа (при V < Nb аргумент логарифма делается отрицательным).
Зная свободную энергию, можно определить давление газа:
OF NT та
или
(p+~-)(V-Nb)^NT. (76,7)
Это и есть искомое интерполяционное уравнение состояния реального газа—уравнение ван-дер-Ваальса. Разумеется, оно является лишь одной из бесчисленных возможных интерполяционных формул, удовлетворяющих поставленным требованиям, и нет никаких физических оснований для выбора одной из них. Формула ван-дер-Ваальса является лишь наиболее простой и удобной'). Из (76,6) можно найти энтропию газа
S = S„e +.iVln(l-^), (76,8)
а затем его энергию Е = F-\-TS.
Е = ЕЯЛ-^. (76,9)
Отсюда видно, что теплоемкость Cv = (dE/dT)v ван-дер-ваальсов-ского газа совпадает с теплоемкостью идеального газа, она зависит только от температуры и, в частности, может быть постоянной. Теплоемкость же Ср, как легко убедиться (см. задачу 1), зависит не только от температуры, но и от объема, и потому не может сводиться к постоянной.
Второй член в (76,9) соответствует энергии взаимодействия молекул газа; он, естественно, отрицателен, так как между молекулами в среднем преобладают силы притяжения.
Задач и
1. Найти Ср—Cv для неидеального газа, описываемого формулой ван-дер-
Ваальса.
Решение. С помощью формулы (16,10) и уравнения ван-дер-Ваальса находим:
С —С N
2. Найти уравнение адиабатического процесса для ван-дер-ваальсовского
газа с постоянной теплоемкостью Cv.
Решение. Подставляя в (76,8) Sajl = N In V-\-Ncv In Г (несущественные постоянные опускаем) и приравнивая S постоянной, найдем соотношение
| 1) При конкретном применении этой формулы значения постоянных а и 6 следует выбирать так, чтобы получить наилучшее согласие с опытом. Постоянную Ь при этом уже отнюдь нельзя рассматривать как учетверенный объем молекулы,— даже в случае одноатомного газа. |
(V—Nb) TCv=* const.
Оно отличается от соответствующего уравнения для идеального газа заменой V на V—Nb.
3. Для такого же газа найти изменение температуры при расширении в
пустоту от объема Vt до объема V2.
Решение. При расширении в пустоту остается постоянной энергия газа. Поэтому из формулы (76,9) (с £Ha = A7Ct,T) находим
т т Na (1 1
Ti-Tl=-c7{T;-v;
4. Для ван-дер-ваальсовского газа найти зависимость точки инверсии процес-
са Джоуля—Томсона от температуры.
Решение. Точка инверсии определяется равенством (dT/dV)p =T/V (см. (74,9)). После подстановки Т из (76,7) оно дает уравнение, которое должно быть решено совместно с (76,7). Алгебраическое вычисление приводит к следующей зависимости точки инверсии от давления:
г„-$(,±]Л=5!
При каждом давлении Р < а/363 имеется две точки инверсии, между которыми производная (дТ/дР)^ положительна, а вне этого интервала температур отрицательна. При Р > а/362 точки инверсии отсутствуют и везде (dTjdP)w < О1).
§ 77. Связь вириального коэффициента с амплитудой рассеяния
При вычислении вириальных коэффициентов в §§ 74—76 мы исходили из классической статистики, что практически всегда оправдано. Представляет, однако, методический интерес вопрос о вычислении этих коэффициентов в квантовом случае; реально такой случай может представить гелий при достаточно низких температурах. Покажем, каким образом может быть вычислен второй вириальный коэффициент с учетом квантования парного взаимодействия частиц газа (Е. Beth, G. Е. Uhlenbeck, 1937). Мы будем рассматривать одноатомный газ, атомы которого не обладают электронным моментом; имея в виду случай гелия, будем для определенности считать также, что ядра атомов не имеют спина и что атомы подчиняются статистике Бозе.
В интересующем нас приближении достаточно сохранить в формуле (35,3), определяющей потенциал О, лишь первые три члена суммы по N:
Q«- Т InJ 1 +2^-£i«)/r +Ъ^-Е*пУТ\■ (77,1)
| х) Рассмотренному в конце § 74 случаю соответствует верхняя точка инверсии при Р—>-0(Тхяв = 2а/Ь). Нижняя точка инверсии при малых Р в газе может отсутствовать ввиду его конденсации в жидкость. |
Здесь Еы обозначают уровни энергии отдельного атома, a Ein — уровни энергии системы двух взаимодействующих атомов. Нашей целью является вычисление лишь тех поправочных членов в термодинамических величинах, которые связаны с непосредственным
взаимодействием атомов; поправки же, связанные с квантовомеха-ническими обменными эффектами, имеющиеся уже в идеальном газе, определяются формулой (56,15), согласно которой обменная часть второго вириального коэффициента равна (в случае статистики Бозе)
Во6м = -1-(лАутТГ'\ (77,2)
Таким образом, наша задача сводится к вычислению суммы
Z<*>=2exp(2-t^),
причем из нее должно еще быть вычтено выражение, которое получилось бы для двух невзаимодействующих атомов.
Уровни энергии Е2п складываются из кинетической энергии движения центра инерции обоих атомов (р2/4т, где р—импульс этого движения, m—масса атома) и энергии их относительного движения. Последнюю мы обозначим через е; это есть уровни энергии частицы с массой т/2 (приведенная масса двух атомов), движущейся в центральном поле U12 (г) (£/13 — потенциальная энергия взаимодействия атомов). Движение центра инерции всегда квазиклассично, и, производя обычным образом интегрирование по его координатам и импульсам (ср. § 42), получим
Z(2> =уе2ц/т^£_у*^е~е'т.
Если обозначить посредством ZB3 ту часть суммы Z(2>, которая связана со взаимодействием частиц, то можно написать Q в виде
Рассматривая второй член как малую добавку к первому и выражая его через Т, V и N (с помощью формулы (45,5) для химического потенциала идеального газа), получим для свободной энергии выражение
Дифференцируя по V, получим давление, причем интересующая нас обусловленная взаимодействием атомов часть вириального коэффициента равна
Ввз(7') = -8(^)3/Хз. (77,3)
Спектр уровней энергии е состоит из дискретного спектра отрицательных значений (соответствующих финитному относительному движению атомов) и непрерывного спектра положительных значений (инфинитное движение). Первые обозначим посредством е„; вторые же можно написать в виде р2/т, где р—импульс относительного движения атомов, разошедшихся на большое расстояние друг от друга. Сумма
2в|Е«,/г
п
по дискретному спектру входит в ZB3 целиком. Из интеграла же по непрерывному спектру надо отделить часть, соответствующую свободному движению невзаимодействующих частиц. Для этого применим следующий прием.
На больших расстояниях г волновая функция стационарного состояния с орбитальным моментом / и положительной энергией р2/т имеет асимптотический вид
. const / р In. j. \
где фазы 8, = 6г(/?) зависят от конкретного вида поля с712(г) (см. III, § 33). Положим формально, что область изменения расстояния г ограничена весьма большим, но конечным значением R. Тогда импульс р сможет принимать лишь дискретный ряд значений, определяющихся граничным условием, требующим обращения ij) в нуль при r = R:
■jrfl—-у + 6, = 5Я,
где s—целые числа. Но при большом R ряд этих значений очень густ, и в сумме
р
можно перейти к интегрированию. Для этого при заданном / умножаем суммируемое выражение на
и интегрируем по dp, после чего результат должен еще быть умножен на 21 +1 (кратность вырождения по направлениям орбитального момента) и просуммирован по
2 е-р^т = 1 ^ (21 + 1) | (| + fl) e-'Wdp. Для частиц, подчиняющихся статистике Бозе и не обладающих
спином, координатные волновые функции должны быть симметричными; это значит, что допустимы лишь четные значения /, так что суммирование по / производится по всем четным числам.
При свободном движении все фазы 8г = 0. Поэтому выражение, остающееся при 6г = 0, есть та часть суммы, которая должна быть отброшена как не связанная со взаимодействием атомов. Таким образом, получаем для искомого ZB3 следующее выражение:
ZB3= Ев1 е" '/r +12? (21 + 1) *$Le-P^rdp> (77i4)
п I о
а вириальный коэффициент fi = Во6м + 5ВЗ равен
В (Т) --1 (-^f-)'" (1 + 16ZB3). (77,5)
Как известно фазы 8( определяют амплитуду рассеяния частиц, движущихся в поле U]2(r), согласно формуле1)
f (Q) = wE{21 +l) {е™1~1} р< (cos е)-i
где Р1 — полиномы Лежандра, 6 — угол между направлениями падения и рассеяния; суммирование в данном случае производится по всем четным значениям /. В связи с этим оказывается возможным выразить интеграл в (77,4) через амплитуду рассеяния. Именно, легко проверить непосредственной подстановкой выражения для /(0) справедливость следующего соотношения:
Стоящая же слева сумма как раз входит в подынтегральное выражение в (77,4), и в результате его подстановки (и интегрирования по частям в одном из членов) получим
оо
Zb3=Е е'8" 1/Г + J P'e-p^r [f(0)+ /* (0)]dp+
Если в поле (712 (г) имеются дискретные уровни, то при достаточно низких температурах температурная зависимость В(Т) будет в основном определяться экспоненциально возрастающей
х) См. III, § 123. Сечение рассеяния в элемент телесного угла do есть I/(9)|2do.
с уменьшением Т суммой по дискретным уровням. Дискретные уровни, однако, могут и отсутствовать вовсе; тогда вириальный коэффициент будет зависеть от температуры по степенному закону (если учесть, что при р—^0 амплитуда рассеяния стремится к постоянному пределу, то легко найти, что при достаточно низких температурах В будет определяться в основном членом Bo6J.
Отметим, что в случае слабого взаимодействия, когда столкновения частиц могут быть описаны борцовским приближением, амплитуда рассеяния мала, и третий член в (77,6), квадратичный по этой амплитуде, может быть опущен. При слабом взаимодействии отсутствуют связанные состояния, а потому отсутствует и первый член в (77,6). Используя известное выражение для амплитуды рассеяния /(0) в борновском приближении, пропорциональное интегралу ^U12r2dr, легко убедиться в том, что выражение для F в точности совпадает с формулой (32,3) (без квадратичного члена), как и должно было быть в этом случае.
Задача
В квазиклассическом случае определить квантовую поправку (порядка %2) в вириальном коэффициенте В (Г) одноатомного газа.
Решение. Поправка к классической свободной энергии дается формулой (33,15). Учитывая, что в данном случае осуществляется лишь парное взаимодействие атомов и что U12—функция только расстояния между атомами, найдем
_j^_'?(dU^y e-ult/Tr4r ~ 6mT*){ dr J 6 f ar-о
Это выражение представляет собой поправку к основному, классическому значению, даваемому формулой (74,5). Отметим, что Вив > 0.
§ 78. Термодинамические величины классической плазмы
Изложенный в § 75 метод вычисления термодинамических величин неидеального газа заведомо непригоден для газа, состоящего из заряженных частиц, взаимодействующих по закону Кулона, так как в этом случае входящие в формулы интегралы расходятся. Поэтому такой газ требует особого рассмотрения.
Рассмотрим полностью ионизованный газ (плазма). Заряды его частиц будем обозначать посредством zae, где индекс а отличает различные сорта ионов (е — элементарный заряд, za — положительные и отрицательные целые числа). Пусть далее па0 есть число ионов а-го сорта в единице объема газа. Газ в целом, разумеется, электрически нейтрален, т. е.
%гапа0 = 0. (78Д)
Будем считать, что газ слабо отклоняется от идеальности. Для этого во всяком случае необходимо, чтобы средняя энергия кулоновского взаимодействия двух ионов (~(ге)2/г, где r~n~1/3— среднее расстояние между ионами) была мала по сравнению со средней кинетической энергией ионов (~Т). Таким образом, должно быть (ге)2пг/3 *^.Т или
п<{^*У- (78-2)
Ввиду электронейтральности плазмы среднее значение энергии кулоновского взаимодействия ее частиц, если бы все они были равномерно распределены в пространстве независимо друг от друга, обратилось бы в нуль. Поэтому первые поправки в термодинамических величинах плазмы (по сравнению с их значениями в идеальном газе) возникают только при учете корреляции между положениями различных частиц. С целью напоминать об этом обстоятельстве, будем называть эти поправки корреляционными.
Начнем с определения поправки в энергии плазмы. Как известно из электростатики, энергия электрического взаимодействия системы заряженных частиц может быть написана в виде половины суммы произведений зарядов на потенциалы поля, создаваемого в точках их нахождения всеми остальными зарядами. В данном случае
£коРР = У- уЕздоФв. (78,3)
а
где фа — потенциал поля, действующего на ион а-го сорта со стороны остальных зарядов. Для вычисления этих потенциалов поступим следующим образом1).
Каждый из ионов создает вокруг себя некоторое (в среднем сферически-симметричное) неравномерно заряженное ионное облако. Другими словами, если выбрать какой-либо из ионов в газе и рассматривать плотность распределения остальных ионов относительно данного, то эта плотность будет зависеть только от расстояния г от центра. Обозначим плотность распределения ионов (а-го сорта) в этом ионном облаке посредством па. Потенциальная энергия каждого иона а-го сорта в электрическом поле вокруг данного иона есть гаец>, где ср — потенциал этого поля. Поэтому, согласно формуле Больцмана (38,6), имеем
rta = tto0exp(-i^). (78,4)
J) Излагаемый метод был применен Дебаем и Хюккелем для вычисления термодинамических величин сильных электролитов (P. Debye, Е. Htickel, 1923).
Постоянный коэффициент положен равным паВ, так как вдали от центра (где <р —»- 0) плотность ионного облака должна переходить в среднюю ионную плотность в газе.
Потенциал ср поля в ионном облаке связан с плотностью зарядов в нем (равной 2е2Л) электростатическим уравнением Пуассона
Дф== — 4я<?2 zana. (78,5)
а
Формулы (78,4—5) составляют вместе систему уравнений самосогласованного электрического поля электронов и ионов.
При сделанном нами предположении об относительной слабости взаимодействия ионов энергия егац> мала по сравнению с Т, и формулу (78,4) можно написать приближенно в виде
"а = "аО-^ф. (78,6)
Подставив это выражение в (78,5) и имея в виду условие (78,1) нейтральности газа в целом, получим уравнение
Аф — х2ф = 0, (78,7)
где введено обозначение
*2 = ^Ц«ао^.' (78,8)
а
Величина и имеет размерность обратной длины.
Центрально-симметричное решение уравнения (78,7) есть
е~"лг
Ф = const —.
В непосредственной близости от центра поле должно переходить в чисто кулоновское поле данного заряда (величину которого обозначим как zbe). Другими словами, при достаточно малых г должно быть ужегь/г\ поэтому надо положить const—zbe, так что искомое распределение потенциала дается формулой
„ Ф = е2б-^1. (78,9)
Отсюда видно, кстати, что поле становится очень малым на расстояниях, больших по сравнению с 1/и. Поэтому длину 1/к можно рассматривать как определяющую размеры ионного облака, создаваемого данным ионом (ее называют также дебаевским радиусом). Все производимые здесь вычисления, конечно, предполагают, что этот радиус велик по сравнению со средними расстояниями между ионами (это условие совпадает, очевидно, с условием (78,2)).
Разлагая потенциал (78,9) в ряд при малых кг, найдем Ф = ^—ezbn+...
Опущенные члены обращаются при г = 0 в нуль. Первый член есть кулоново поле самого данного иона. Второй же член есть, очевидно, потенциал, создаваемый всеми остальными ионами облака в точке нахождения данного иона; это и есть та величина, которая должна быть подставлена в формулу (78,3): срв = — егак.
Таким образом, мы получаем следующее выражение для корреляционной части энергии плазмы:
£KoPP = -Y^2Ertao^ = -Ve3 Yt(Е^У", (78,10)
а \ а /
или, вводя полные числа различных ионов в газе Na — na0V:
£корр=-е - У w (Е ад)8/а. (78,11)
Эта энергия обратно пропорциональна квадратному корню из температуры и из объема газа.
Е д F
Интегрируя термодинамическое соотношение — —-gf f >
можно найти из Екою соответствующую добавку к свободной
энергии:
F = F*-24 Уw(E«)3/2 (7М2)
(постоянную интегрирования надо положить равной нулю, так как при Т—>-оо должно быть F — Fm). Отсюда давление
NT _____ е>_
V зуз/а
j/'ffE^y73 - (78,13)
где N = ^Na. Термодинамический потенциал Ф можно получить из F с помощью теоремы о малых добавках (как это было сделано и в § 74), т.е. рассматривая второй член в (78,12) как малую добавку к Fsli и выразив ее с нужной точностью через переменные Р и Г1):
| *) Для перехода от (78,11) к (78,12) такой способ не мог быть применен, поскольку энергия (78,11) не была выражена через необходимые для этого переменные S и V. |
ф=фад-ж(^)1/8(Е«)4/а- <78>14>
§ 79. Метод корреляционных функций
Преимущество изложенного в предыдущем параграфе метода Дебая — Хюккеля состоит в его простоте и физической прозрачности. С другой стороны, его основной недостаток заключается в невозможности обобщения для вычисления следующих приближений по концентрации. Мы изложим поэтому вкратце также и другой метод (предложенный Н. Н. Боголюбовым, 1946), хотя и более сложный, но позволяющий в принципе вычислить также и следующие члены разложения термодинамических величин.
Этот метод основан на рассмотрении так называемых корреляционных функций между одновременными положениями нескольких частиц в заданных точках пространства. Простейшей и наиболее важной из них является бинарная корреляционная функция wab, пропорциональная вероятности найти одновременно две частицы (иона) в заданных точках ха и хь (оба иона а и Ь могут быть как одного, так и разных родов). Ввиду изотропии и однородности газа эта функция зависит, конечно, лишь от г = |ть — га\. Мы выберем нормировочный коэффициент в функции wab таким образом, чтобы она стремилась к единице при г—>-оо.
Если функция wab известна, искомая энергия ЕК09Р может быть найдена путем интегрирования по очевидной формуле1)
£к0Рр = £ NaNb j j uabwabdVadVb, (79,1)
a, b
где суммирование ведется по всем родам ионов, а иаЬ — энергия кулоновского взаимодействия пары ионов на расстоянии г.
Согласно формуле распределения Гиббса функция wab дается следующим выражением:
™ab = yj^rr J ехр { F-F^-U } dV.dV,... dVN-t, (79,2)
где U — энергия кулоновского взаимодействия всех ионов, а интегрирование производится по координатам всех ионов, за исключением двух данных ионов. Для приближенного вычисления этого интеграла воспользуемся следующим приемом.
Дифференцируем равенство (79,2) по координатам иона Ь:
| 1) Сама по себе эта формула не связана, конечно, с кулоновским характером взаимодействия частиц и предполагает лишь его парность. |
dwab wab диаЬ 1_VW Г диЬс „■ лу (-JQ Q\

в результате чего система сводится к одному уравнению
Дсо (г) — и2со (г) = ^ б (г). (79,8)
Это окончательное уравнение имеет ту же форму, что и уравнение (78,7) в методе Дебая — Хюккеля (член с б-функцией в (79,8) соответствует граничному условию при г—у 0, накладываемому на функцию ср (г) в (78,7)). Решение уравнения (79,8):
чем и определяются бинарные корреляционные функции в плазме.
Для вычисления энергии достаточно подставить теперь wab из (79,4), (79,7), (79,9) в (79,1). Переходя к интегрированию по относительным координатам двух частиц, находим
Якорр = -1 £ пап„ J. - " 4яг* dr
а, Ь О
(член 1 в wab не дает вклада в энергию в силу условия электрической нейтральности плазмы). Произведя интегрирование, вернемся к прежнему результату (78,11).
В следующем приближении вычисления становятся более громоздкими. В частности, предположение (79,5) теперь недостаточно, и следует ввести тройные корреляции, не сводящиеся уже к бинарным. Для них получается уравнение, аналогичное (79,3), содержащее теперь четверные корреляции, которые, однако, в данном (втором) приближении сводятся к тройным1).
§ 80. Термодинамические величины вырожденной плазмы
В изложенной в § 78 теории предполагалось, что плазма далека от вырождения, т. е. подчиняется статистике Больцмана. Рассмотрим теперь ситуацию, когда температура плазмы настолько низка, что ее электронная компонента уже вырождена:
аГ<^./1»/«, (80,1)
где т—масса электрона (ср. (57,8)); при этом ионная компонента благодаря большой массе ионов может быть еще далека от вырож-
х) Члены следующего порядка в термодинамических величинах плазмы фактически вычислены (другим методом) А. А. Веденоеым и А. И. Ларкиным, ЖЭТФ 36, 1133 (1959).
дения. Напомним, что условие слабой неидеальности вырожденной плазмы состоит в требовании
mz2/3e2 Рп1/3
<1 (80,2)
(см. (57,9)); оно выполняется тем лучше, чем выше плотность плазмы.
Для вырожденного газа удобными переменными являются (помимо температуры Т и объема V) его химические потенциалы р0 вместо чисел частиц Ма1). Соответственно этому будем вычислять Q—термодинамический потенциал по отношению к этим переменным. Отметим, что химические потенциалы не являются при этом все независимыми переменными; они связаны друг с другом одним соотношением, следующим из условия электрической нейтральности плазмы:
а а
Воспользуемся формулой
/еа \ —(ёИ\
выражающей производную от Q по некоторому параметру к через среднее значение такой же производной от гамильтониана системы (ср. аналогичные формулы (11,4), (15,11)). В данном случае выберем в качестве параметра X квадрат заряда е2. Гамильтониан плазмы содержит е2 в виде общего коэффициента в операторе кулоновского взаимодействия частиц 0. Поэтому
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 345; Нарушение авторских прав?; Мы поможем в написании вашей работы!