
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
S: Установите правильную последовательность
|
|
|
|
Учебной дисциплины.
Учебно-методическое и информационное обеспечение
Основная литература
1. В. И. Слесарев Химия. Основы химии живого: учебник СПб: Химиздат. 2010.
2. Н. Л.Глинка: ред. В.А.Попков, А.В.Бабков Общая химия: учебник М.: Юрайт, 2011.
3. В. А. Попков, А. В. Бабков, Л. И. Трофимов и др. Химия биогенных элементов: учеб. Пособие для вузов М.: Юрайт, 2012.
4. Е. Ф. Вайс. Неорганическая химия. Лабораторный практикум для студентов 1 курса фармацевтического факультета / Е. Ф. Вайс, О. А. Голубцова, - Красноярск: «ЛИТЕРА-принт», 2007. – 132 стр.
5. Е. Ф. Вайс. Общая и рнеорганиченская химия. Лекции для самостоятельной внеаудиторной работы студентов 1 курса фармацевтического факультета / Е. Ф. Вайс, О - Красноярск: «ЛИТЕРА-принт», 2007. – 192 стр.
Дополнительная литература
6. Вайс Е.Ф. Общая и неорганическая химия [Электронный ресурс]: сб. тестовых заданий с эталонами ответов для студентов 1 курса, обучающихся по спец.060301- Фармация.- Режим доступа:http^//krasgmu.vmede.ru/index.php?pade[common]=elib8cat=8<res id=1987 x
7. Вайс Е.Ф. Общая и неорганическая химия: сб. ситуационных задач с эталонами ответов для студентов, обучающихся по спец. 060301 -Фармация.
Теория электролитической диссоциации:
1: электролиты при растворении в воде распадаются (диссоциируют) на положительные и отрицательные ионы
2: под действием электрического тока положительно заряженные ионы движутся к катоду, отрицательно заряженные ионы – к аноду. Поэтому первые называются катионами, вторые – анионами
3: диссоциация – процесс обратимый, поскольку параллельно идет распад молекул на ионы (диссоциация) и процесс соединения ионов в молекулы (ассоциация)
I: {{237}}
S:Молярная концентрация 0,4 н. раствора азотной кислоты равна
+:0,4 моль/дм3;
-: 0,2 моль/дм3;
-: 0,5 моль/дм3;
-: 0,1 моль/дм3.
I: {{238}}
S:Массовая доля раствора сульфата алюминия равна, если он получен смешением растворов массами 140 и 190 г с массовыми долями 30 и 45 % соответственно
-: 25,4 %;
-: 41,7 %;
+:38,6 %;
-: 27,5 %.
I: {{239}}
S:Эквивалентная концентрация фосфорной кислоты равна, если в растворе объёмом
200 см3 содержится H3PO4 массой 4,9 г
-: 0,55 моль/дм3;
+:0,75 моль/дм3;
-: 1,03 моль/дм3;
-: 0,27 моль/дм3.
I: {{240}}
S:Осмотическое давление раствора равно, если при 17 С в 250 см³ его содержится
0,3 моль вещества
-: 2578 кПа;
-: 2380 кПа;
+:2892 кПа;
-: 3075 кПа.
I: {{241}}
S:Массовая доля (%) вещества в оставшемся растворе равна, если из 400 г 17 % раствора хлорида натрия выделилось при охлаждении 0,6 моль вещества
-: 7;
+: 9;
-: 13;
-: 15.
I: {{242}}
S:Масса хлорида аммония, которую следует добавить к 178,6 г 14 % раствора того же вещества, чтобы получить 19,6 % раствор, равна
-: 10 г;
+:12,4 г;
-: 51 г;
-: 70 г.
I: {{243}}
S:Масса 30 % хлороводородной кислоты, требуемая для приготовления 27 % раствора хлороводородной кислоты массой 200 г, равна
-: 22,2 г;
-: 66,7 г;
+: 180 г;
-: 200 г.
I: {{244}}
S:Масса 20 % раствора хлорида натрия, в котором следует растворить 60 г того же вещества, чтобы получить 26 % раствор, равна
-: 120 г;
-: 260 г;
-: 300 г;
+:740 г.
I: {{245}}
S:Масса хлорида калия, требуемая для приготовления 440,5 см3 раствора с массовой долей 20 % (ρ = 1,135 г/см3), равна
+: 100 г;
-: 200 г;
-: 300 г;
-: 400 г.
I: {{246}}
S:Объём воды, который надо добавить к 143 см3 (r = 1,049 г/см3) 40 % уксусной кислоты, чтобы приготовить 30 % кислоту, равен
-: 15 см3;
-: 45 см3;
+:50 см3
-: 60 см3.
I: {{247}}
S:Масса (г) карбоната натрия, требуемая для приготовления 0,5 дм3 13 % раствора
(r = 1,13 г/см3), равна
+: 73,5;
-: 80,5;
-: 60,8;
-: 18,2.
I: {{248}}
S:Масса оксида кальция, необходимая для приготовления 495 г раствора гидроксида кальция с массовой долей 1,5 %, равна
+:5,6 г;
-: 6,7 г;
-: 8,2 г;
-: 15,1 г.
I: {{249}}
S:Массовая доля кислоты в полученном растворе равна, если он получен смешением растворов серной кислоты массами 120 и 40 г с массовыми долями 20 и 50 % соответственно
+:27,5%;
-: 30,2 %;
-: 40,5 %;
-: 56,3 %.
I: {{250}}
S:Масса азотной кислоты, которая содержится в 1дм3 раствора с массовой долей 20 %
(ρ = 1,05 г/ см3), равна
+: 210 г;
-: 250 г;
-: 300 г;
-: 450 г.
I: {{251}}
S:Массовая доля хлорида натрия в полученном растворе равна, если к 180 г 8 % раствора хлорида натрия добавили 20 г NaCℓ
+: 17,2 %;
-: 20,3 %;
-: 25,5 %;
-: 30,6 %.
I: {{252}}
S:Массовая доля вещества в полученном растворе равна, если он получен смешением растворов азотной кислоты 195 см3 (ρ = 1,026 г/см3) и 284 см3 (ρ = 1,056 г/см3) с массовыми долями 5 и 10 % соответственно
-: 3 %;
+: 8 %;
-: 12 %;
-: 15 %.
I: {{253}}
S:Масса воды, в которой следует растворить 60,5 г Cu(NO3)2∙3H2O для приготовления 15,67 % раствора нитрата меди(II), равна
-: 86,3 г;
-: 184,5 г;
+:239,4 г;
-: 253 г.
I: {{254}}
S:Объём (см3) 5 % раствора сульфата меди(II) (ρ = 1,052 г/см3), который следует добавить к 177 см3 12 % раствора (ρ = 1,135 г/см3) сульфата меди(II), чтобы получить 10 % раствор, равен
-: 45,6;
-: 68;
+:76;
-: 80.
I: {{255}}
S:Объём воды (см3), который следует добавить к 195 см3 раствора сульфата магния с массовой долей 7 % (ρ = 1,025 г/ см3), чтобы приготовить 3,11 % раствор, равен
-: 80;
+:250;
-: 300;
-: 370.
I: {{256}}
S:Массовая доля вещества в конечном растворе равна, если он получен смешением раствора нитрата калия 365 см3 15 % (ρ = 1,096 г/см3) и 17,2 г того же вещества
-: 12,0 %;
-: 14,4 %;
+:18,5 %;
-: 19,3 %.
I: {{257}}
S:Масса воды, которую следует выпарить из 430 см3 раствора с массовой долей 4 %
(ρ = 1,047 г/см3) сульфида натрия, чтобы получить 12 % раствор, равна
-: 50 г;
-: 250 г;
+: 300 г;
-: 400 г.
I: {{258}}
S:Масса 16,7 % раствора гидроксида калия, в котором следует растворить 0,5 моль того же вещества, чтобы получить 40 % раствор, равна
-: 67 г;
+:72 г;
-: 120 г;
-: 140 г.
I: {{259}}
S:Масса воды, в которой следует растворить 16 г MgSO4·7H2O, чтобы получить 13 % раствор сульфата магния, равна
-: 8,5 г;
+:44 г;
-: 52,2 г;
-: 107 г.
I: {{260}}
S:Масса (г) 16 % раствора хлорида бария, в котором следует растворить 25 г того же вещества, чтобы получить 20 % раствор, равна
-: 200;
-: 312,5;
+:500;
-: 625.
I: {{261}}
S:Масса Zn(NO3)2·6H2O, необходимая для приготовления 750 г 12,6 % раствора нитрата цинка, равна
-: 54 г;
-: 89,5 г;
-: 94,5 г;
+:148,5 г.
I: {{262}}
S:Массовая доля вещества в конечном растворе равна, если после упаривания 4,75 дм3 раствора хлорида натрия с массовой долей 7,5 % (ρ = 1,0527 г/см3) масса раствора уменьшилась на 1,875 кг
+: 12 %;
-: 16 %;
-: 18 %;
-: 20 %.
I: {{263}}
S:Количество вещества сульфата магния, которое следует добавить к 270 г 5,55 % раствора этого вещества, чтобы получить 15 % раствор, равно
-: 0,15 моль;
+:0,25 моль;
-: 0,3 моль;
-: 0,45 моль.
I: {{264}}
S:Объём воды (см3), который надо добавить к 257,6 см3 раствора сульфата алюминия с массовой долей 15 % (ρ = 1,165 г/см3), чтобы приготовить 6 % раствор, равен
-: 180 см3;
-: 330 см3;
+: 450 см3;
-: 705. см3.
I: {{265}}
S:Массовая доля вещества в оставшемся растворе равна, если при охлаждении из 400 г 30 % раствора нитрата натрия выделилось 50 г NaNO3
-: 17,5 %;
+:20 %;
-: 30 %;
-:34,3 %.
I: {{266}}
S:Масса 24 % раствора сульфата аммония, необходимая для приготовления 150 г раствора с массовой долей 20 %, равна
-: 60 г;
-: 85,3 г;
-: 100 г;
+: 125 г.
I: {{267}}
S:Масса 10 % раствора хлорида калия, в котором следует растворить 0,202 моль того же вещества, чтобы получить 20 % раствор, равна
-: 150 г;
+: 120 г;
-: 75 г;
-: 30 г.
I: {{268}}
S:Масса хлорида натрия, которую следует добавить к 175 г раствора с массовой долей 8,1 %, чтобы получить 20 % раствор NaCℓ, равна
-: 18 г;
-: 21 г;
+: 26 г;
-: 35 г.
I: {{269}}
S:Объём (см3) 20 % раствора гидроксида калия (ρ = 1,19 г/см3), который необходим для приготовления 250 см3 раствора с концентрацией вещества 3 моль/ дм3, равен
+:176,5;
-: 200;
-: 215;
-: 297,5.
I: {{270}}
S:Масса FeSO4·7H2O, необходимая для приготовления 316,7 г раствора сульфата железа(II) с массовой долей 12 %, равна
-: 30,4 г;
-: 38 г;
-: 54 г;
+: 69,5 г.
I: {{271}}
S:Масса воды, необходимая для приготовления 400 г раствора с массовой долей нитрата калия 20 %, равна
-: 360 г;
-: 160 г;
+: 80 г;
-: 320 г.
I: {{272}}
S:Концентрация раствора (моль/кг) этиленгликоля (тосол), замерзающего при -37,2 оС (Ккр.(Н2О) = 1,86), составляет
-: 40;
+:20;
-: 10;
-: 2.
I: {{273}}
S:Объём раствора (см3) нитрата бария с молярной концентрацией 0,1 моль/дм3, необходимый для осаждения сульфат-ионов из 100 см3 раствора серной кислоты с молярной концентрацией 0,2 моль/дм3, равен
+: 200;
-: 100;
-: 150;
-: 250.
I: {{274}}
S:Масса осадка, образующегося при сливании 50 см3 раствора нитрата серебра с молярной концентрацией 0,2 моль/дм3 и 100 см3 раствора хлорида натрия с молярной концентрацией 0,1 моль/дм3, равна
-: 0,72 г;
-: 2,88 г;
-: 2,16 г;
+: 1,44 г.
I: {{275}}
S:Молярная масса неэлектролита равна, если температура кристаллизации раствора
-0,93 оС (Ккр.(Н2О) = 1,86), содержащего неэлектролит массой 9,2 г в воде массой 400 г
+:46 г/моль;
-: 60 г/моль;
-: 92 г/моль;
-: 120 г/моль.
I: {{276}}
S:Масса растворённого вещества, содержащегося в 0,5 дм3 раствора нитрата калия с концентрацией 0,1 моль/дм3, равна
-: 50,1 г;
+:5,05 г;
-: 101 г;
-: 10,1 г.
I: {{277}}
S:Осмотическое давление раствора глицерина (С3Н8О3), если молярная концентрация 0,1 моль/дм3 при 25 С, равно
+:247,6 кПа;
-: 61,9 кПа;
-: 51,6 кПа;
-: 123, 8 кПа.
I: {{278}}
S:Установите соответствие между свойством дисперсной системы и его определением
L1: абсорбция
L2: элюция
L3:
L4:
R1: поглощение газа или пара всем объёмом твёрдого тела
R2: удаление адсорбированных веществ с адсорбентов при помощи растворителей
R3: поглощение веществ из одной фазы другой фазой
R4: поглощение газов, паров и растворённых веществ поверхностью других веществ
I: {{279}}
S:Установите соответствие между учёным и формулировкой его закона
L1: Вант-Гоффа
L2: Рауля
L3:
L4:
R1: осмотическое давление равно тому давлению, которое производило бы растворённое вещество, если бы оно в виде идеального газа занимало тот же объём, который занимает раствор, при той же температуре
R2: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворённого нелетучего вещества
R3: понижение давления пара над раствором по сравнению с давлением над чистым растворителем вызывает повышение температуры кипения и понижение температуры кристаллизации по сравнению с чистым растворителем
R4: гомогенные равновесные многокомпонентные системы, достигшие минимума энергии Гиббса за счёт всех видов взаимодействия между всеми видами частиц
I: {{280}}
S:Установите соответствие между названием дисперсной системы и её обозначением
L1: пена
L2: аэрозоль
L3:
L4:
R1: жидкость – газ
R2: газ – жидкость
R3: жидкость – твёрдое тело
R4: жидкость – жидкость
I: {{281}}
S:Установите соответствие между названием дисперсной системой и её определением
L1: эмульсия
L2: пена
L3:
L4:
R1: несмешивающиеся жидкости
R2: состоят из ячеек, заполненных газом и отдёленных друг от друга жидкими или твёрдыми пленками очень малой толщины
R3: взвеси твёрдых частиц в жидкости
R4: концентрированные взвеси твёрдых частиц в жидкости
I: {{282}}
S:Установите соответствие между названием системы и её определением
L1: перенасыщенный
L2: насыщенный
L3:
L4:
R1: система, в которой скорость растворения меньше скорости кристаллизации
R2: система, в которой скорость растворения равна скорости кристаллизации
R3: система, в которой скорость растворения больше скорости кристаллизации
R4: система, в которой скорость кристаллизации неизменна
I: {{283}}
S:Установите соответствие между названием системы и её определением
L1: эмульсии
L2: пены
L3:
L4:
R1: несмешивающиеся жидкости
R2: состоят из ячеек, заполненных газом и отделённых друг от друга жидкими или твёрдыми плёнками очень малой толщины
R3: взвеси твёрдых частиц в жидкости
R4: концентрированные взвеси твёрдых частиц в эмульсии
I: {{284}}
S:Установите соответствие между названием системы и её определением
L1: суспензии
L2: эмульсии
L3:
L4:
R1: взвеси твёрдых частиц в жидкости
R2: несмешивающиеся жидкости
R3: состоят из ячеек, заполненных газом и отделённых друг от друга жидкими или твёрдыми плёнками очень малой толщины
R4: концентрированные взвеси твёрдых частиц в эмульсии
I: {{285}}
S:Установите соответствие между названием системы и её определением
L1: суспензии
L2: пены
L3:
L4:
R1: взвеси твёрдых частиц в жидкости
R2: состоят из ячеек, заполненных газом и отделённых друг от друга жидкими или твёрдыми плёнками очень малой толщины
R3: концентрированные взвеси твёрдых частиц в эмульсии
R4: несмешивающиеся жидкости
I: {{286}}
S:Установите соответствие между названием системы и её определением
L1: пасты
L2: эмульсии
L3:
L4:
R1: концентрированные взвеси твёрдых частиц в эмульсии
R2: несмешивающиеся жидкости
R3: состоят из ячеек, заполненных газом и отделённых друг от друга жидкими или твёрдыми плёнками очень малой толщины
R3: взвеси твёрдых частиц в жидкости
I: {{287}}
S: Степень дисперсности является количественной характеристикой
+:дисперсности вещества;
-: степени электролитической диссоциации;
-: общей поверхности частиц;
-: суммарного объёма частиц.
I: {{288}}
S: Анион - это
+: отрицательно заряженный ион;
-: положительно заряженный ион;
-: нейтрально заряженный ион;
-: позитрон.
I: {{289}}
S: Буферная ёмкость - это
+: предельное количество кислоты или щёлочи, определенной концентрации, которое можно добавить к 1 дм3 буферного раствора, чтобы значение рН его изменилось только на единицу;
-: растворы, рН которых резко не изменяются при добавлении к ним умеренных количеств кислот, щёлочей, а также при умеренном разбавлении;
-: отрицательный десятичный логарифм концентрации [Н+];
-: степень отклонения экспериментальных значений Росм, Dtкип, Dtзам от теоретически рассчитанных.
I: {{290}}
S: Предельное количество кислоты или щёлочи, определенной концентрации, которое можно добавить к 1 дм3 буферного раствора, чтобы значение рН его изменилось только на единицу - это
+: буферная ёмкость;
-: буферное действие;
-: буферный раствор;
-: индикатор.
I: {{291}}
S: Буферные растворы - это
-: предельное количество кислоты или щёлочи, определенной концентрации, которое можно добавить к 1 дм3 буферного раствора, чтобы значение рН его изменилось только на единицу;
+: растворы, рН которых резко не изменяются при добавлении к ним умеренных количеств кислот, щёлочей, а также при умеренном разбавлении;
-: отрицательный десятичный логарифм концентрации [Н+];
-: степень отклонения экспериментальных значений Росм, Dtкип, Dtзам от теоретически рассчитанных.
I: {{292}}
S: Процесс растворения в жидкостях газов и жидкостей можно рассматривать как фазовый переход из
-: твёрдого в жидкое состояние;
-: твёрдого в газообразное состояние;
+: газообразного в жидкое состояние;
+: жидкого в твёрдое состояние.
I: {{293}}
S: Растворение в жидкостях газов и жидкостей аналогичен процессу
-: плавления;
-: возгонки;
-: кристаллизации;
+: конденсации.
I: {{294}}
S: Растворение в жидкостях газов и жидкостей процесс
-: эндотермический;
+: экзотермический;
-: без выделения теплоты;
-: с неупорядоченным выделением теплоты.
I: {{295}}
S: Максимальное количество вещества, которое способно раствориться в 100 г воды при данных условиях с образованием насыщенного раствора называется
-: водородным показателем;
+: коэффициентом растворимости;
-: буферной ёмкостью;
-: буферным действием.
I: {{296}}
S: Растворимость газов в воде с повышением температуры
+: уменьшается;
-: увеличивается;
-: остается неизменной;
-: изменяется хаотично.
I: {{297}}
S: Формулировка закона Генри
+: растворимость газов в жидкостях прямопропорциональна его парциальному давлению;
-: предельное количество кислоты или щёлочи, определенной концентрации, которое можно добавить к 1 дм3 буферного раствора, чтобы значение рН его изменилось только на единицу;
-: растворы, рН которых резко не изменяются при добавлении к ним умеренных количеств кислот, щёлочей, а также при умеренном разбавлении;
-: отрицательный десятичный логарифм концентрации [Н+].
I: {{298}}
S: Растворимость газов в жидкостях прямопропорциональна его парциальному давлению – это формулировка закона
+: Генри;
-: Вант-Гоффа;
-: Рауля;
-: Менделеева.
I: {{299}}
S: Изотонический коэффициент - это
-: предельное количество кислоты или щёлочи, определенной концентрации, которое можно добавить к 1 дм3 буферного раствора, чтобы значение рН его изменилось только на единицу;
-: растворы, рН которых резко не изменяются при добавлении к ним умеренных количеств кислот, щёлочей, а также при умеренном разбавлении;
-: отрицательный десятичный логарифм концентрации [Н+];
+: степень отклонения экспериментальных значений Росм, Dtкип, Dtзам от теоретически рассчитанных.
I: {{300}}
S: Степень отклонения экспериментальных значений Росм, Dtкип, Dtзам от теоретически рассчитанных называется
+: изотоническим коэффициентом;
-: эбуллиоскопическим коэффициентом;
-: криоскопическим коэффициентом;
-: степенью электролитической диссоциации.
I: {{301}}
S: Изотонические - это
+: растворы, характеризующиеся одинаковым осмотическим давлением;
-: растворы, рН которых резко не изменяются при добавлении к ним умеренных количеств кислот, щёлочей, а также при умеренном разбавлении;
-: слабые органические кислоты (основания), изменяющие свою окраску с изменением рН среды;
-: система, внутри которой нет поверхности раздела, отделяющей друг от друга части системы.
I: {{302}}
S: Растворы, характеризующиеся одинаковым осмотическим давлением, называются
+: изотоническими;
-: изобарическими;
-: эбуллиокопическими;
-: криоскопическими.
I: {{303}}
S: Индикаторы - это
-: растворы, характеризующиеся одинаковым осмотическим давлением;
-: растворы, рН которых резко не изменяются при добавлении к ним умеренных количеств кислот, щёлочей, а также при умеренном разбавлении;
+: слабые органические кислоты (основания), изменяющие свою окраску с изменением рН среды;
-: система, внутри которой нет поверхности раздела, отделяющей друг от друга части системы.
I: {{304}}
S: Процесс растворения твёрдых веществ в жидкостях можно рассматривать как фазовый переход из
+: твёрдого в жидкое состояние;
-: твёрдого в газообразное состояние;
-: газообразного в жидкое состояние;
-: жидкого в твёрдое состояние.
I: {{305}}
S: Растворение твёрдых веществ в жидкостях аналогичен процессу
+: плавления;
-: возгонки;
-: кристаллизации;
-: конденсации.
I: {{306}}
S: Растворение твёрдых веществ в жидкостях процесс
+: эндотермический;
-: экзотермический;
-: без выделения теплоты;
-: с неупорядоченным выделением теплоты.
I: {{307}}
S: Коллоидные растворы - это
+: высокодисперсные, ультрамикрогетерогенные системы с размерами частиц от 10–9 до 10–7 м;
-: размер частиц от 10–7 до 10–6 м;
-: размер частиц меньше 10–11 м;
-: размер частиц от 10–11 до 10–9 м.
I: {{308}}
S: Высокодисперсные, ультрамикрогетерогенные системы с размерами частиц от 10–9 до 10–7 м, называются
+: коллоидными растворами;
-: истинными растворами;
-: разбавленными растворами;
-: идеальными растворами.
I: {{309}}
S: Концентрация раствора - это
+: содержание растворённого вещества в определённой массе или в определенном объёме раствора или растворителя;
-: растворы, характеризующиеся одинаковым осмотическим давлением;
-: растворы, рН которых резко не изменяются при добавлении к ним умеренных количеств кислот, щёлочей, а также при умеренном разбавлении;
-: слабые органические кислоты (основания), изменяющие свою окраску с изменением рН среды.
I: {{310}}
S: Содержание растворённого вещества в определённой массе или в определенном объёме раствора или растворителя - это
+: концентрация раствора;
-: содержание раствора;
-: цвет раствора;
-: индикатор.
I: {{311}}
S: Коэффициент растворимости - это
+: максимальное количество вещества, которое способно раствориться в
100 г воды при данных условиях с образованием насыщенного раствора;
-: предельное количество кислоты или щёлочи, определенной концентрации, которое можно добавить к 1 дм3 буферного раствора, чтобы значение рН его изменилось только на единицу;
-: растворы, рН которых резко не изменяются при добавлении к ним умеренных количеств кислот, щёлочей, а также при умеренном разбавлении;
-: степень отклонения экспериментальных значений Росм, Dtкип, Dtзам от теоретически рассчитанных.
I: {{312}}
S: Максимальное количество вещества, которое способно раствориться в
100 г воды при данных условиях с образованием насыщенного раствора называется
+: коэффициентом растворимости;
-: концентрацией раствора;
-: содержанием раствора;
-: цветом раствора.
I: {{313}}
S: Лиофильные золи - это
+: растворы высокомолекулярных соединений, крахмала, белков, каучука;
+: растворы высокомолекулярных соединений, в них взаимодействие (сольватация) очень велико и золь стабилен без введения стабилизатора;
-: золи металлов, малорастворимые оксиды и соли;
-: золи металлов, в них практически отсутствует взаимодействие между частицами золя и растворителя.
I: {{314}}
S: Растворы высокомолекулярных соединений, в них взаимодействие (сольватация) очень велико и золь стабилен без введения стабилизатора, называются
+: лиофильными золями;
-: лиофобными золями;
-: суспензиями;
-: пенами.
I: {{315}}
S: Лиофобные золи - это
-: растворы высокомолекулярных соединений, крахмала, белков, каучука;
-: растворы высокомолекулярных соединений, в них взаимодействие (сольватация) очень велико и золь стабилен без введения стабилизатора;
+: золи металлов, малорастворимые оксиды и соли;
+: золи металлов, в них практически отсутствует взаимодействие между частицами золя и растворителя.
I: {{316}}
S: Золи металлов, малорастворимые оксиды и соли, в них практически отсутствует взаимодействие между частицами золя и растворителя, называются
-: лиофильными золями;
+: лиофобными золями;
-: суспензиями;
-: пенами.
I: {{317}}
S: Растворы с осмотическим давлением, большим, чем у внутриклеточного содержимого, называются
+: гипертоническими;
-: гипотоническими;
-: изобарическими;
-: изотоническими.
I: {{318}}
S: Гипертонический – это раствор
+: с осмотическим давлением, большим, чем у внутриклеточного содержимого;
-: с осмотическим давлением, меньшим, чем у внутриклеточного содержимого;
-: с одинаковым осмотическим давлением;
-: с разным осмотическим давлением.
I: {{319}}
S: Растворы с осмотическим давлением, меньшим, чем у внутриклеточного содержимого, называются
-: гипертоническими;
+: гипотоническими;
-: изобарическими;
-: изотоническими.
I: {{320}}
S: Гипотонический – это раствор с
-: осмотическим давлением, большим, чем у внутриклеточного содержимого;
+: осмотическим давлением, меньшим, чем у внутриклеточного содержимого;
-: одинаковым осмотическим давлением;
-: разным осмотическим давлением.
I: {{321}}
S: Название метода определения молекулярной массы по понижению температуры замерзания ###
+: криоскопи#$#
I: {{322}}
S: Название метода определения молекулярной массы по повышению температуры кипения
-: криоскопия;
+: эбуллиоскопия;
-: метастатический;
-: оптимальный.
I: {{323}}
S: Осмотическое давление 0,5 М раствора глюкозы (С6Н12О6) при 25 оС равно
-: 0,24 МПа;
+: 1,24 МПа;
-: 1,45 МПа;
-: 1,07 МПа.
I: {{324}}
S: Осмотическое давление раствора, содержащего сахар (С12Н22О11) массой 16 г в воде массой 350 г (ρ = 1 г/см3) при 293К равно
-: 248 кПа;
+: 311 кПа;
-: 450 кПа;
-: 107 кПа.
I: {{325}}
S: Осмотическое давление 0,25 М раствора глюкозы (С6Н12О6) при 25 оС равно
-: 0,84 МПа;
+: 0,62 МПа;
-: 0,55 МПа;
-: 1,07 МПа.
I: {{326}}
S: Буферными свойствами обладает раствор, содержащий вещества
+: CH3COONa и CH3COOH;
-: NH4Cl и CH3COONa;
-: CH3COONa и NH4OH;
-: NH4Cl и CH3COOH.
I: {{327}}
S: Буферными свойствами обладает раствор, содержащий вещества
-: CH3COONa и NH4Cl;
+: NH4Cl и NH4OH;
-:NH4Cl и CH3COOH;
-: CH3COOH и NH4OH.
I: {{328}}
S: В водном растворе вещество, поверхностное натяжение которого меньше, чем у воды, преимущественно находится
+: в поверхностном слое;
-: в объёме жидкости;
-: в нижнем слое жидкости;
-: равномерно распределено во всем объёме жидкости.
I: {{329}}
S: Масса чистого вещества (г), содержащегося в 2 дм3 раствора серной кислоты с молярной концентрацией 0,2 моль/дм3
+: 39,2;
-: 34,5;
-: 40,8;
-: 29,7.
I: {{330}}
S: Потенциалопределяющий ион коллоидного раствора, полученного при взаимодействии избытка иодида калия с нитратом серебра
+: I-;
-: Ag+;
-: NO3-;
-: K+.
I: {{331}}
S: В лаборатории электрофорез используют для определения _____ коллоидной частицы
+: знака заряда;
-: размера;
-: цвета;
-: объёма.
I: {{332}}
S: Моляльность (моль/кг) раствора составляет, если в 1 дм3 воды растворили этиленгликоль и полученный раствор замерзает при температуре 282,3К {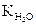 = 1,86
= 1,86 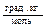 }
}
+: 5;
-: 3;
-: 6;
-: 4.
I: {{333}}
S: Количество моль HNO3, содержащихся в 2 дм3 раствора азотной кислоты с рН = 2
+: 0,01;
-: 0,02;
-: 0,1;
-: 2,0.
I: {{334}}
S: Количество моль гидроксида натрия, содержащихся в 1 дм3 NaOH, имеющего рН = 13
+: 0,1;
-: 1,0;
-: 40,0;
-: 4,0.
I: {{335}}
S: Масса (г) соли, содержащейся в 400 см3 раствора с молярной концентрацией нитрата натрия 0,2 моль/дм3
+: 68;
-: 34;
-: 72;
-: 56.
I: {{336}}
S: Масса (г) растворенного вещества, содержащегося в растворе нитрата калия объёмом 0,5 дм3 и концентрацией 0,1 моль/дм3
+: 5,05;
-: 50,05;
-: 25,05;
-: 15,05.
I: {{337}}
S: Потенциалопределяющим является ион для золя гидроксида железа, полученного гидролизом его хлорида
+: ОН-;
-: Н+;
-: Fe2+;
-: Cl-.
I: {{338}}
S: Ион, обладающий наилучшим коагулирующим действием для золя иодида серебра, полученного по реакции AgNO3 + KJ(изб)→ AgJ + КNO3
+: Al3+;
-: K+;
-: Zn2+;
-: J-.
I: {{339}}
S: Ион, обладающий наилучшим коагулирующим действием lля золя иодида серебра, полученного по реакции AgNO3(изб) + KJ→ AgJ + КNO3
+: РО43;
-: Na+;
-: J-;
-: NO3-.
I: {{340}}
S: Ион, обладающий наилучшим коагулирующим действием для золя, полученного по реакции 2H3ASO3 + 3H2S(изб.) = As2S3 + 6H2O
+: Al3+;
-: K+;
-: Zn2+;
-: J-.
I: {{341}}
S: Масса (г) гидроксида натрия, содержащаяся в растворе необходимом для нейтрализации 100 см3 раствора азотной кислоты с молярной концентрацией 0,2 моль/дм3
+: 0,8;
-: 0,6;
-: 1,0;
-: 1,2.
I: {{342}}
S: Объём раствора гидроксида калия с молярной концентрацией 0,2 моль/дм3 необходимый для нейтрализации 200 см3 раствора серной кислоты с молярной концентрацией
0,1 моль/дм3
+: 200;
-: 100;
-: 150;
-: 250.
I: {{343}}
S: Количество (моль) гидроксида натрия необходимые для нейтрализации 40 см3 раствора уксусной кислоты с молярной концентрацией 0,5 моль/дм3
+: 0,02;
-: 0,01;
-: 0,03;
-: 0,04.
I: {{344}}
S: Масса (г) растворённого вещества, необходимая для приготовления раствора CuSO4 массой 540 г с моляльной концентрацией 0,5 моль/кг
+: 47;
-: 37;
-: 55;
-: 60.
I: {{345}}
S: Дым и туман относятся к дисперсным системам типа
+: аэрозоль;
-: суспензия;
-: эмульсия;
-: пена.
I: {{346}}
S: Значение рОН в растворе, рН которого 10
+: 4;
-: 2;
-: 10;
-: -2.
I: {{347}}
S: Ион, адсорбирующийся на поверхности ядра и определяющий заряд коллоидной частицы (гранулы) называется
+: потенциалопределяющим;
-: ионообразующим;
-: ядром;
-: мицеллой.
I: {{348}}
S: Коагуляцию золя сульфата бария, полученного по реакции
ВаCl2(изб) + K2SO4 → BaSO4 + 2KCl, вызывают
+: анионы электролита;
-: катионы электролита;
-: растворитель;
-: инертная добавка.
I: {{349}}
S: Коагуляция коллоидных растворов может протекать под действием
+: сильных электролитов;
-: слабых электролитов;
-: инициаторов;
-: катализаторов.
I: {{350}}
S: Заряд коллоидной частицы, полученной при взаимодействии раствора хлорида бария с избытком серной кислоты
+: отрицательный;
-: положительный;
-: не имеет заряда;
-: заряд плавно изменяется от положительно к отрицательному.
I: {{351}}
S: Заряд коллоидной частицы, полученной при взаимодействии раствора серной кислоты с избытком раствора хлорида бария
-: отрицательный;
+: положительный;
-: не имеет заряда;
-: заряд плавно изменяется от положительно к отрицательному.
I: {{352}}
S: Коллоидная частица, образующаяся при взаимодействии избытка нитрата серебра с йодидом калия, в электрическом поле
+: перемещается к отрицательному электроду;
-: перемещается к положительному электроду;
-: перемещается к катоду;
-: не перемещается.
I: {{353}}
S: Коллоидные системы, в которых растворитель (вода) взаимодействует с ядрами коллоидных частиц, называются
+: гидрофильными;
-: гидрофобными;
-: изотоническими;
-: гипертоническими.
I: {{354}}
S: Концентрация ионов водорода (сН+) в растворе, рН которого равен 2, составляет _____ моль/дм3
+: 1∙10-2;
-: 2∙10-2;
-: 1∙10-12;
-: 2∙10-12;
I: {{355}}
S: Концентрация ионов водорода в чистой воде при 25 оС равна ____ моль/дм3
+: 1∙10-7;
-: 2∙10-14
-: 1∙10-12;
-: 2∙10-2;
I: {{356}}
S: Концентрация ПАВ в поверхностном слое по сравнению с концентрацией в объеме жидкости
+: значительно выше;
-: значительно ниже;
-: равномерна по всему объёму;
-: изменяется по синусоиде.
I: {{357}}
S: Раствор, в котором лакмус окрашен в синий цвет
+: CH3COONa;
+: Na2CO3;
-: AlCl3;
-: ZnSO4.
I: {{358}}
S: Молярная концентрация вдвое меньше молярной концентрации эквивалентов для раствора
+: ZnSO4;
-: AlCl3;
-: NaCl;
+: Na2SO4.
I: {{359}}
S: Молярная масса неэлектролита, раствор 9,2 г которого в 400 г воды замерзает при -0,93 оС {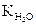 = 1,86
= 1,86 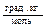 }, равна ___г/моль
}, равна ___г/моль
+: 46;
-: 92;
-: 40;
-: 68.
I: {{360}}
S: Потенциалопределяющим ионом коллоидной частицы (гранулы), полученной по уравнению AgNO3+NaI(изб.) = AgI+NaNO3, является
-: Ag+;
-: Na+;
-: NO3-;
+: J-.
Окислительно-восстановительные реакции (ОВР)
I: {{1}}
S: Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются
+: окислительно-восстановительными реакциями;
-: реакциями обмена;
-: реакциями разложения;
-: реакциями замещения.
I: {{2}}
S: Отношение молярной массы восстановителя к числу потерянных электронов одной молекулой восстановителя называется
+: эквивалентной массой восстановителя;
-: эквивалентной массой окислителя;
-: эквивалентной массой соли;
-: эквивалентной массой элемента.
I: {{3}}
S: Установите правильную последовательность
Степень окисления элемента в соединении вычисляется
1: все металлы имеют положительную степень окисления;
2: фтор во всех соединениях (–1);
1) постоянную степень окисления в соединениях проявляют щелочные металлы (+1), металлы главной подгруппы II, цинк и кадмий (+2);
3: водород проявляет степень окисления (+1) во всех соединениях, кроме гидридов металлов, где степень окисления его равна (–1);
4: степень окисления кислорода в соединениях равна (–2), за исключением пероксидов (–1) и фторида кислорода (+2);
5: алгебраическая сумма степеней окисления всех атомов входящих в состав молекул, равна нулю;
6: степень окисления элементов в простых веществах принимается равной нулю.
I: {{4}}
|
|
|
|
|
Дата добавления: 2014-10-31; Просмотров: 1702; Нарушение авторских прав?; Мы поможем в написании вашей работы!