
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ядерная модель атома. Формула резерфорда. 4 страница
|
|
|
|
Спин – квантовая характеристика, не имеющая классических аналогов и являющаяся внутренним свойством квантовых объектов, характеризующая их равноправно с такими величинами, как масса или электрический заряд.
С точки зрения теоретической физики спин – это дополнительная степень свободы квантовой частицы.
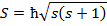
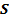 - спин, собственный механический момент
- спин, собственный механический момент
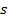 - спиновое квантовое число, характеризующее ту или иную частицу
- спиновое квантовое число, характеризующее ту или иную частицу

Спин в отличии от орбитального механического момента строго фиксирован для данной частицы и принимает единственное значение.
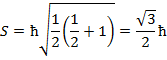
Но его проекция также, как и орбитального момента – квантуется.
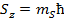
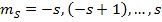 - магнитное спиновое квантовое число
- магнитное спиновое квантовое число
Гиромагнитное отношение для спиновых моментов:
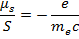
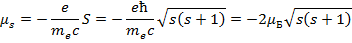
Говорят, что спиновый момент обладает удвоенным магнетизмом, этот факт – одно из доказательств того, что спин нельзя представить, как вращение частицы относительно собственного диаметра.
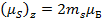 - проекция магнитного спинового момента квантуется и у электрона может принимать два значения:
- проекция магнитного спинового момента квантуется и у электрона может принимать два значения:
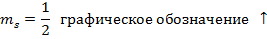
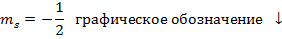
Т.о. магнитный момент атома складывается из трех составляющих:
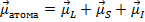
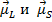 - магнитные моменты орбитальной оболочки
- магнитные моменты орбитальной оболочки
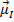 - магнитный момент ядра. В атомной физике обычно не учитывается ввиду малости по сравнению с магнитными моментами электронной оболочки.
- магнитный момент ядра. В атомной физике обычно не учитывается ввиду малости по сравнению с магнитными моментами электронной оболочки.
Опыты Штерна и Герлаха доказали существование у атомов магнитных моментов, явление их квантования, а также существование спина электрона.
Схема эксперимента Штерна и Герлаха.
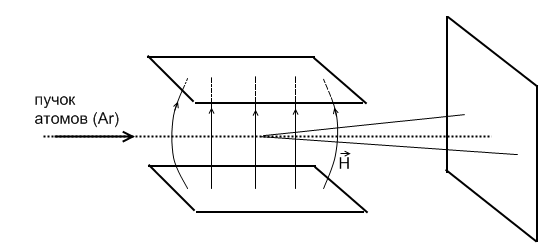
Серебро было выбрано, т.к. у него один валентный электрон. Между пластинами создавалось магнитное поле 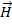 , сильно неоднородное на атомных расстояниях
, сильно неоднородное на атомных расстояниях 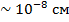
Было установлено, что пучек атомов серебра расщеплялся относительно начального направления на два симметричных пучка, это расщепление связано с взаимодействием магнитных моментов атомов и приложенного магнитного поля.
Дополнительная энергия, приобретаемая атомом в магнитном поле:
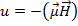
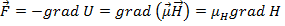
Если бы проекция момента не квантовалась, то в силу неравенства:
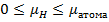
мы бы наблюдали на экране сплошную полосу. В действительности на экране наблюдались отдельные пятна. Т.о. было доказано явление квантования магнитных и механических моментов.
Покажем, что из опыта Штерна и Герлаха следует существование спина у электрона.
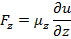
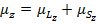
Предположим, что 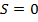 , тогда
, тогда 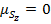 , тогда:
, тогда:
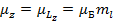
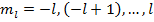
Всего 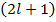 значений
значений 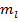 при любых
при любых 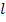 нечетное, т.е. пучок должен разбиваться на 1, 3, 5, …
нечетное, т.е. пучок должен разбиваться на 1, 3, 5, …
Для объяснения четного количества компонент на экране рассмотрим атом серебра с одним валентным электроном на внешней оболочке.
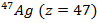
Для атома серебра в основном состоянии орбитальное квантовое число 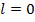 . Тогда
. Тогда 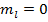 ,
, 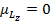 . В данном случае магнитный момент чисто спиновый.
. В данном случае магнитный момент чисто спиновый.

Т.к. для одного электрона на внешней оболочке возможно всего две проекции 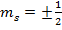 спинового момента, то весь пучок разбивается на две компоненты.
спинового момента, то весь пучок разбивается на две компоненты.
Глава: Теория атомов и молекул.
§28. Спектр атома водорода.
Для атома водорода 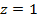
Потенциальная энергия в кулоновском поле ядра:
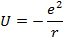
Запишем УШ для атома водорода (единственное уравнение атомной физики, которое можно решить аналитически):
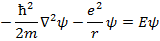
Для решения данного уравнения необходимо перейти к сферической СК, при этом УШ решается методом разделения переменных и решение имеет следующий вид:
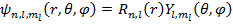
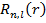 – радиальная часть
– радиальная часть
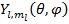 - сферические или шаровые функции
- сферические или шаровые функции
УШ допускает два типа решений:
1) 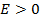 , энергия принимает любые положительные значения, соответствует инфинитному движению электрона, т.е. когда не существует атома, а есть система протон-электрон.
, энергия принимает любые положительные значения, соответствует инфинитному движению электрона, т.е. когда не существует атома, а есть система протон-электрон.
2) 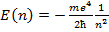 – спектр энергий атома в связанном состоянии.
– спектр энергий атома в связанном состоянии.
Энергия водорода зависит только от главного квантового числа, в то время как волновая функция определяется тремя числами 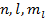 , уровни энергии атома водорода вырождены по орбитальному и магнитноорбитальному квантовым числам
, уровни энергии атома водорода вырождены по орбитальному и магнитноорбитальному квантовым числам 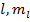
Пример.
Пусть водород находится в первом состоянии.
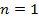
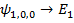
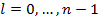
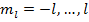
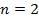
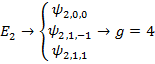
Второй энергитический уровень водорода четырехскоростно вырожден.
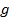 -статистический вес уровня или кратность его вырождения, количество различных состояний системы, при которых ее энергия одинакова.
-статистический вес уровня или кратность его вырождения, количество различных состояний системы, при которых ее энергия одинакова.
Вырождение по орбитальному квантовому числу для водорода случайно, т.к. электростатическое поле протона и электрона – кулоново.
Независимость энергии от 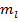 связано с изотропией пространства. Изотропию можно нарушить, создавая магнитное или электрическое поле, при этом вырождение по
связано с изотропией пространства. Изотропию можно нарушить, создавая магнитное или электрическое поле, при этом вырождение по 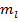 снимается.
снимается.
Найдем кратность вырождения уровня энергии водорода. Любому квантовому числу 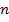 соответствует
соответствует 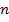 значений
значений 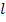 , каждому из которых отвечает
, каждому из которых отвечает 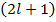 значений
значений 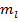 , т.о. для любого зафиксированного
, т.о. для любого зафиксированного 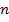 кратность вырождения:
кратность вырождения:
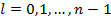
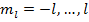

С учетом спина электрона:
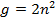
В спектроскопии уровни энергии атомов обозначают:
1) 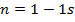
2) 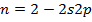
3) 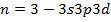
Обобщенная формула Бальмера для спектроскопии волнового числа:
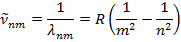
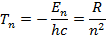
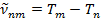
Схема уровней атома водорода.
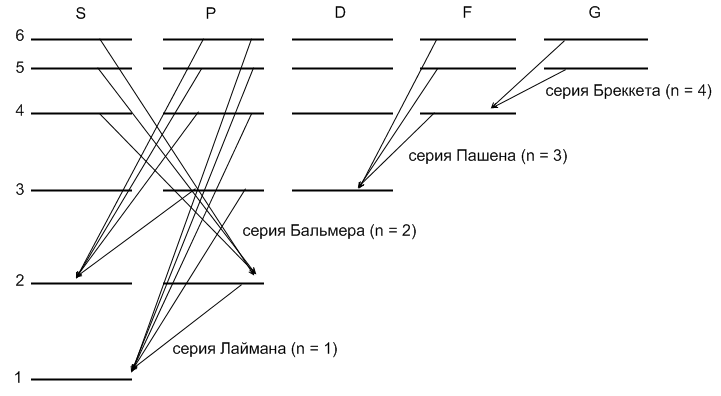
Правила отбора для радиационных переходов являются следствием закона сохранения четности, а также закона сохранения момента импульса в дипольном приближении.
Правила отбора заключаются в следующем. При радиационных переходах возможны следующие изменения квантовых чисел.
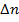 – может изменяться произвольно
– может изменяться произвольно
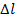 - на
- на 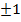
Таким образом S уровни комбинируют только с P уровнями.
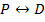
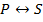
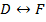
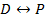
Рассмотрим волновые функции атома водорода:
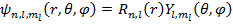
Сферические функции 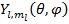 являются собственными функциями оператора квадрата момента импульса
являются собственными функциями оператора квадрата момента импульса 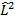 , при
, при 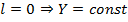
Рассмотрим плотность вероятности
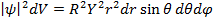
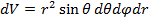
Вероятность обнаружить электрон на расстоянии 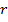 от протона при данных
от протона при данных 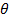 и
и 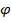

§29. Щелочные металлы.
Щелочные металлы образуют первую группу периодической системы элементов и имеют один валентный электрон на внешней оболочке. Внутренние электроны и ядро атома щелочного металла образуют прочный остов.
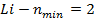
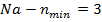
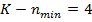
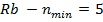
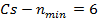
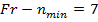
В случае щелочного металла электростатическое поле, как и у водорода, сферически симметрично, но уже не кулоново. Если внешний электрон находится на значительном расстоянии от остова, то он движется в поле с эффективным электрическим зарядом 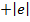 . При проникновении внешнего электрона в остов, он поляризуется и его эффективный заряд изменяется, поэтому потенциальную энергию валентного электрона можно представить:
. При проникновении внешнего электрона в остов, он поляризуется и его эффективный заряд изменяется, поэтому потенциальную энергию валентного электрона можно представить:
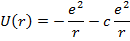
 - поле точечного заряда
- поле точечного заряда
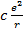 - поле диполя
- поле диполя
Подставляя данную формулу потенциальной энергии в УШ и решая последнее, получаем спектр энергии щелочного металла:
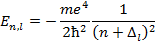
Энергия зависит от двух квантовых чисел 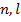 , что связано с некулоновостью поля.
, что связано с некулоновостью поля.
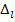 - квантовый дефект или поправка Ридберга.
- квантовый дефект или поправка Ридберга.
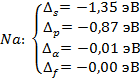
Для водородоподобного атома:
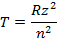
Для щелочных металлов:
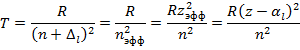
 - зарядовое число
- зарядовое число
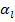 - постоянная экранирования заряда ядра
- постоянная экранирования заряда ядра
Правила отбора для щелочных металлов.
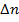 – любое
– любое
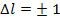
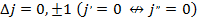
Схема уровней атома натрия:
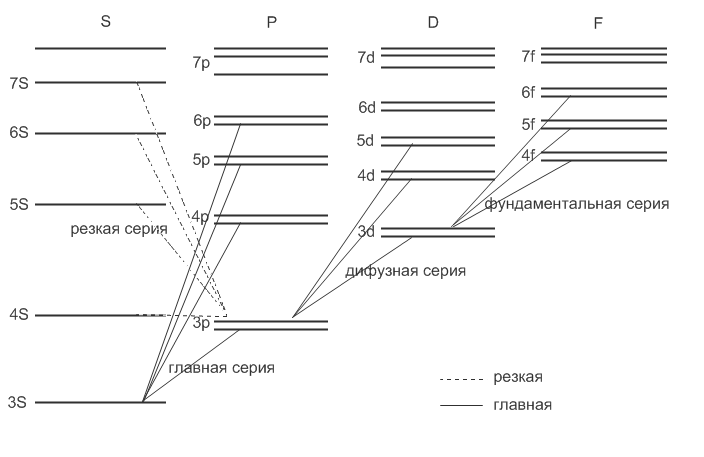
Основные серии щелочного металла:
1) Главная.
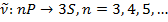
2) Вторая побочная (резкая)
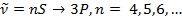
3) Первая побочная (диффузная)
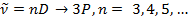
Опытным путем было установлено, что спектральные линии щелочных металлов дублетны (двойные), что связано с тем, что во всех состояниях, кроме 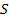 , уровни энергии расщепляются на два уровня. Данное расщепление является следствием спин-орбитального взаимодействия.
, уровни энергии расщепляются на два уровня. Данное расщепление является следствием спин-орбитального взаимодействия.
Под спин-орбитальным взаимодействием понимают взаимодействие магнитного орбитального момента электрона с его спиновым магнитным моментом, в результате чего появляется зависимость энергии атома от спинового квантового числа.
Т.к. в 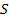 - состоянии
- состоянии 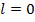 , то спин-орбитального взаимодействия в данном случае нет и уровни энергии одинарные.
, то спин-орбитального взаимодействия в данном случае нет и уровни энергии одинарные.
§. Общая векторная модель атома.
Электроны в атоме имеют орбитальные 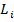 и спиновые
и спиновые 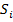 механические моменты, которые складываются в общий или полный механический момент импульса атома:
механические моменты, которые складываются в общий или полный механический момент импульса атома:
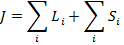
Складывать эти вектора можно различными способами.
Первый способ. 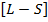 – связь (нормальная связь)
– связь (нормальная связь)
Данный способ реализуется для атомов легких элементов, при этом кулоново отталкивание электронов преобладает над спин-орбитальным взаимодействием. В результате чего каждый электрон обладает собственным орбитальным 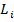 и спиновым
и спиновым 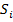 механическими моментами, которые, складываясь по раздельности, дают результирующий орбитальный и спиновый механические моменты атома.
механическими моментами, которые, складываясь по раздельности, дают результирующий орбитальный и спиновый механические моменты атома.
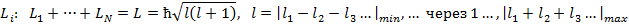
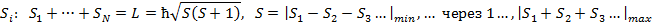
Полный механический момент атома также по квантовым законам определяется, как сумма орбитального и спинового момента.
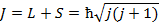
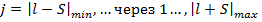
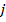 - полное (внутреннее) квантовое число.
- полное (внутреннее) квантовое число.
Как правило, 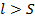 , поэтому вводят характеристику:
, поэтому вводят характеристику:
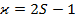
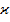 – мультиплетность уровня, число, показывающее, каким количеством способов спин может быть ориентирован относительно орбитального момента. Другими словами, мультиплетность – число подуровней тонкой структуры, соответствующее каждому уровню с данным числом
– мультиплетность уровня, число, показывающее, каким количеством способов спин может быть ориентирован относительно орбитального момента. Другими словами, мультиплетность – число подуровней тонкой структуры, соответствующее каждому уровню с данным числом 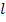 (за исключением
(за исключением 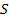 -уровней, у которых
-уровней, у которых 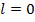 ).
).
Для атомов с одним валентным электроном, спиновое квантовое число 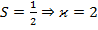 и уровни таких атомов двойные или дублетные.
и уровни таких атомов двойные или дублетные.
Полный механический момент:
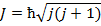
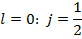
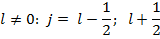
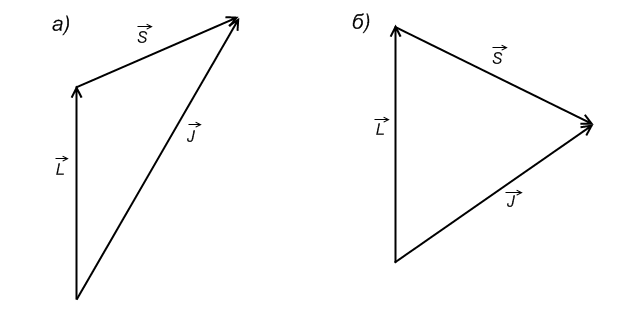
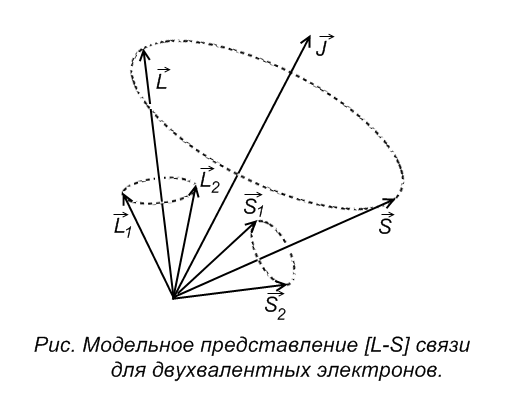
Векторы  и
и  прецессируют вокруг
прецессируют вокруг 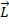 , векторы
, векторы 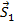 и
и 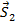 прецессируют вокруг
прецессируют вокруг 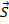 . При этом суммарные векторы
. При этом суммарные векторы 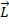 и
и 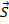 при сложении также прецессируют вокруг вектора
при сложении также прецессируют вокруг вектора 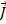 .
.
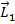 и
и  ;
; 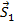 и
и 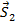 – быстрые прецессии.
– быстрые прецессии.
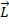 и
и 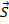 - медленная прецессия.
- медленная прецессия.
В центральном поле сохраняется только вектор 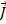 - полный момент импульса, векторы
- полный момент импульса, векторы 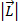 и
и 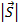 при этом сохраняются только по модулю, но меняют свое направление. Если поместить такой атом в МП, т.е. задать выделенное направление в пространстве, то сохраняться будет только проекция полного момента на выделенное направление.
при этом сохраняются только по модулю, но меняют свое направление. Если поместить такой атом в МП, т.е. задать выделенное направление в пространстве, то сохраняться будет только проекция полного момента на выделенное направление.
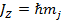

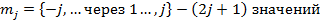
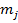 - магнитное внутреннее квантовое число.
- магнитное внутреннее квантовое число.
Если внутренние оболочки атома полностью заполнены, то моменты импульсов  внутренних электронов полностью скомпенсированы
внутренних электронов полностью скомпенсированы 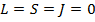 . Т.о. в общей векторной модели атома учитываются только механические и магнитные моменты легких электронов в незаполненных оболочках.
. Т.о. в общей векторной модели атома учитываются только механические и магнитные моменты легких электронов в незаполненных оболочках.
Второй способ. 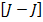 - связь.
- связь.
Характерен для тяжелых атомов с большим количеством валентных электронов, в данном случае, спин-орбитальное взаимодействие каждого электрона преобладает над электростатическим отталкиванием электронов между собой, в результате чего у каждого из них есть полный механический момент.
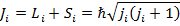
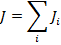
Все моменты складываются в общий механический момент.

Очевидно, что как и в случае 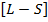 – связи, число возможных значений
– связи, число возможных значений 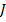 такое же, но уровни энергии при этом будут отличаться, т.к. различна природа взаимодействия. При этом величины:
такое же, но уровни энергии при этом будут отличаться, т.к. различна природа взаимодействия. При этом величины:
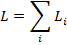
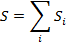
полностью теряют смысл.
§. Тонкая структура спектральных термов
щелочных металлов и атома водорода.
Тонкой структурой называют расщепление энергитических уровней в результате спин-орбитального взаимодействия.
Рассмотрим атом с одним валентным электроном.
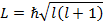
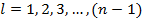
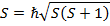
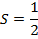
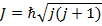

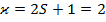
В спектроскопии для обозначения уровня энергии и соответствующего спектрального терма вводится следующая запись:

Например:
Таблица уровней.
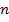
| 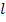
| 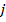
| 
|
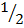
| 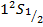
| ||
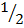
| 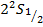
| ||
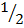
| 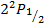
| ||
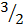
| 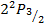
| ||
Для атома водорода уровни энергии вырождены по 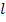 , и, как следует из теории Дирака, для данных значений
, и, как следует из теории Дирака, для данных значений 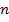 и
и 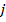 , и разных
, и разных 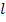 уровни энергии совпадают.
уровни энергии совпадают.
Например:
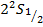
| 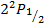
|
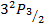
| 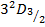
|
Рассмотрим термы водородоподобного атома с учетом тонкой структуры:
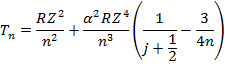
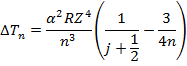
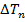 - поправка к термам, учитывающая спин-орбитальное взаимодействие.
- поправка к термам, учитывающая спин-орбитальное взаимодействие.
С ростом зарядового числа 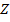 , поправка
, поправка 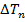 увеличивается. С ростом главного квантового числа
увеличивается. С ростом главного квантового числа 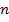 , поправка
, поправка 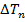 уменьшается.
уменьшается.

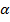 – постоянная тонкой структуры.
– постоянная тонкой структуры.
§. Тонкая структура спектральных линий
щелочных металлов и атома водорода. Лэмбовский сдвиг.
1) Главная серия щелочных металлов.
Правила отбора:
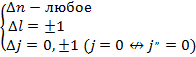
Рассмотрим 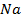 .
.
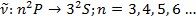
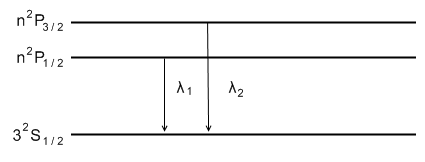
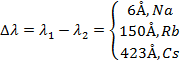
2) Резкая серия
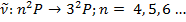
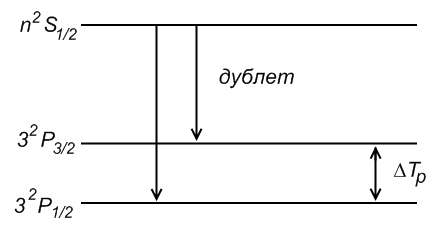
|
|
|
|
|
Дата добавления: 2014-11-20; Просмотров: 500; Нарушение авторских прав?; Мы поможем в написании вашей работы!