
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнение состояния идеального газа
|
|
|
|
И ТЕРМОДИНАМИКА
МОЛЕКУЛЯРНАЯ ФИЗИКА
Задача № 47 (4 балла ) Решение: (ОФ, 2003)
Плотность газа, составляющего шаровую молнию, равна плотности воздуха,
так как молния свободно плавает в воздухе, то: r = r0,
равны, очевидно, и давления: Р = Р 0.
Уравнение Менделеева – Клапейрона:
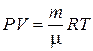 ,
, 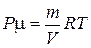 ,
, 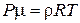 или
или 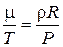 .
.
Правые части последнего уравнения равны для воздуха и газа, составляющего молнию, следовательно, равны и левые части:
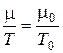 ;
; 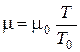 = 86 г/моль (m0 = 29 г/моль).
= 86 г/моль (m0 = 29 г/моль).
Искомое число молекул воды, связанных с ионом азота, найдем из соотношения: 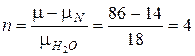 .
.

Задача № 48 (5 баллов ) Решение: (ОФ, 2005)
В соответствии с I- м началом термодинамики, при изохорном процессе
 (1). С другой стороны
(1). С другой стороны  (2). Приравняв (1) и (2), получим:
(2). Приравняв (1) и (2), получим: 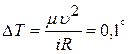 С.
С.
Такой же ответ можно получить, рассуждая по- другому:
На каждую степень свободы молекулы приходится в среднем энергия 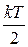 , а после удара к этой энергии добавится
, а после удара к этой энергии добавится 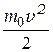 . Тогда:
. Тогда: 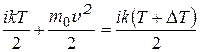 . Из полученного равенства найдём
. Из полученного равенства найдём  :
:
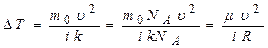 = 0,1°С.
= 0,1°С.
Задача № 49 ( 8 баллов ) Решение: (РОФ, 2005)
 При изотермическом процессе изменение энтропии
При изотермическом процессе изменение энтропии 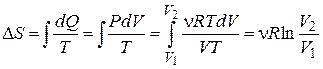 . Поскольку при каждом изотермическом расширении объем газа увеличивается в одно и то же число раз,
. Поскольку при каждом изотермическом расширении объем газа увеличивается в одно и то же число раз, 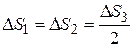 . (1)
. (1)
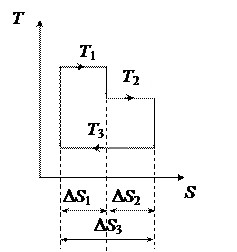
Нарисуем данный цикл в координатах T, S.
К.П.Д. теплового цикла
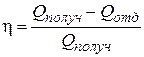 . (2)
. (2)
Газ получает тепло при изотермических расширениях  , (3)
, (3)
и отдает тепло при изотермическом сжатии
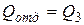 . (4)
. (4)
(3) и (4) подставим в (2)
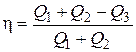 . (5)
. (5)
При изотермическом процессе 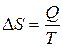 , тогда:
, тогда:
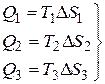 с учетом (1)
с учетом (1) 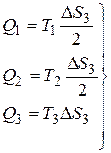 подставляя в (5), получим:
подставляя в (5), получим:
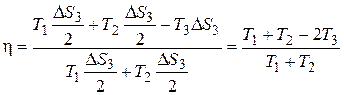 . Окончательно найдём:
. Окончательно найдём:
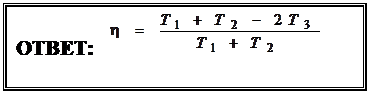 |
Задача № 50 ( 4 балла ) Решение: (ОФ, 2003)
Пусть индексы 1 и 2 обозначают соответственно- атомарный (I) и молекулярный йод (I 2 ). По условию задачи имеем:
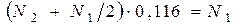 (1),
(1),
где 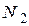 - число молекул, а
- число молекул, а 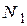 - число атомов йода в сосуде.
- число атомов йода в сосуде.
Так как: 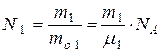 (2) и
(2) и 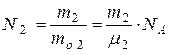 (3),
(3),
где 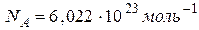 - число Авогадро, то:
- число Авогадро, то:
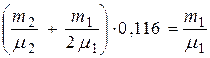 или
или 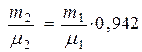 (4). Перепишем (4)
(4). Перепишем (4)
с учётом того, что молярная масса молекулярного йода в 2 раза больше, чем у атомарного (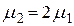 ) в виде:
) в виде: 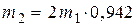 или
или 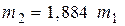 (5).
(5).
Молярная масса атомарного йода равна 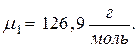
С другой стороны, по закону Дальтона- давление смеси газов равно сумме, так называемых, парциальных давлений. Парциальное давление – давление газа в данном сосуде, создаваемое им в отсутствии других газов.
Тогда получим:
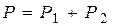 (6), где
(6), где 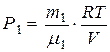 (7) и
(7) и 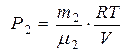 (8). Из (6) – (8) найдём:
(8). Из (6) – (8) найдём: 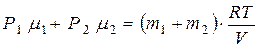 (9) и
(9) и
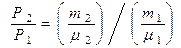 или с учётом (4) получим:
или с учётом (4) получим: 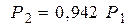 (10).
(10).
Решив линейную систему из двух уравнений (6) и (10), определим 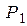 и
и 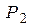 :
:
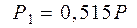 и
и 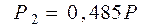 .
.
Искомую массу паров йода в сосуде 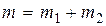 определим из уравнения (9):
определим из уравнения (9):
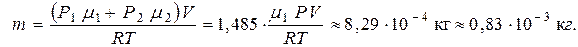
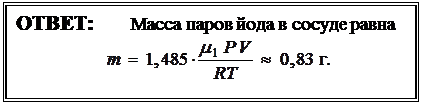 |
Задача № 51 (3 баллов ) Решение: (РОФ, 2000)

Так как по условию все три процесса очень быстрые, то все они являются адиабатическими.
Учитывая, что показатель адиабаты не изменяется (поскольку не меняется состав газа), придём к выводу, что все три точки на PV -диаграмме состояния идеального газа принадлежат одной адиабате.
Искомая работа газа в замкнутом процессе 1-2-3-1 равна площади цикла на PV – диаграмме, которая в данном случае равна нулю.
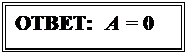
Задача № 52 (4 балла ) Решение: (ОФ, 2006)

Определим величину разности работ A13 и A12. Разность ΔA = A13 - A12 равна ΔS:
ΔS = ½ ((P2 – P3)V1 + P1 (V3 – V2))
где S - площадь под соответствующим участком
1-2 или 1-3. Так как ΔS, очевидно,положительная
величина ((P2 – P3)V1 + P1 (V3 – V2)) > 0, то по первому началу термодинамики получим:
ΔQ 12 = A12 + ΔU12 и ΔQ 13= A13 + ΔU13.С учётом того, что ΔU12 = ΔU13, а также учитывая, что ΔA12 < ΔA13 , получим: Δ Q 13 > Δ Q 12.

ОТВЕТ: Δ Q 13 > Δ Q 12
Задача № 53 ( 6 баллов ) Решение: (РОФ, 1999)
Определим сначала ускорение свободного падения на поверхности данной планеты.
Запишем для тела массы m: 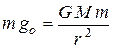 (1). Отсюда:
(1). Отсюда: 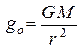 (2).
(2).
Давление, создаваемое атмосферным столбом h, равно: 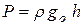 (3), при этом
(3), при этом 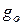 считаем независящим от высоты, т.к. h «r.
считаем независящим от высоты, т.к. h «r.
Из уравнения Менделеева - Клапейрона (PV = 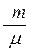 RT) получим:
RT) получим: 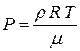 (4). Тогда из уравнений (2), (3) и (4) получим:
(4). Тогда из уравнений (2), (3) и (4) получим: 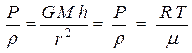 или
или 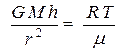 . Окончательно получим:
. Окончательно получим:

Задача № 54 (3 балла ) Решение: (РТ ОФШ 10 кл, 2006)
Полагая приближённо, что при всплытии воздушного пузыря температура воздуха внутри него практически постоянна, запишем в соответствии с законом Бойля-Мариотта для идеального газа: PV = Const или P1 V1 = P 2 V2.
Рассматривая соответствующие давления и объёмы на дне и на поверхности, получим следующее уравнение для определения h:
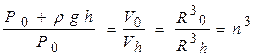 или
или 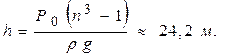

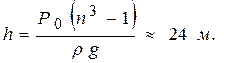
Задача № 55 (5 баллов ) Решение: (РОФ, 2007)
Двигатели НЛО совершают работу над газом, увеличивая его кинетическую энергию. Считая, что в расчёте на единицу времени из двигателей выбрасывается масса газа, равная µ и все частицы газа имеют одинаковые скорости υ, мощность двигателей «тарелки» в момент её зависания равна: 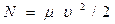 (1).
(1).
Учитывая, что сила тяги двигателей (реактивная сила) равна F = - µ υ, и условие зависания «объекта» (считая, как обычно, лабораторную систему отсчёта инерциальной) имеет вид M g + F = 0, получим:
N = M g υ /2 (2). Отсюда определим ускорение свободного падения:
g = 2N / M υ. (3).
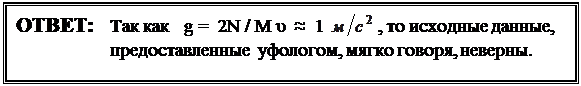
Задача № 56 (4 балла ) Решение: (РОФ, 2007)
Поскольку движение воздуха вверх совершается достаточно быстро возможно рассматривать процесс расширения газа адиабатическим. Тогда из уравнения Пуассона  , а также из уравнения Менделеева – Клапейрона:
, а также из уравнения Менделеева – Клапейрона: 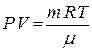 найдём
найдём 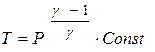 . С учётом барометрической формулы
. С учётом барометрической формулы 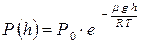 получим зависимость температуры от высоты:
получим зависимость температуры от высоты: 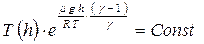 или
или 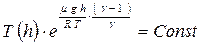 или
или 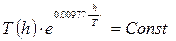 . Для h менее ≈ 3 км
. Для h менее ≈ 3 км 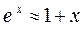
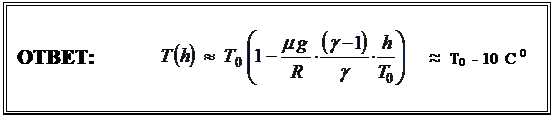 |
Отсюда окончательно получим:
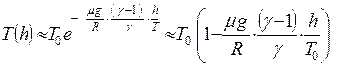
Задача № 57 (4 балла ) Решение: (РОФ, 2010)
Во-первых,давление и концентрация n идеального газа прямо пропорциональны друг другу 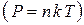 , а во-вторых, исходя из определения идеальности газа, один идеальный газ не влияет на поведение другого
, а во-вторых, исходя из определения идеальности газа, один идеальный газ не влияет на поведение другого 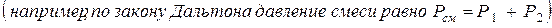 . Таким образом, концентрация газов с разными молярными массами по-разному убывает с высотой. При этом её значение определяется барометрической формулой- частным случаем распределения Больцмана:
. Таким образом, концентрация газов с разными молярными массами по-разному убывает с высотой. При этом её значение определяется барометрической формулой- частным случаем распределения Больцмана: 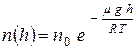 (1).
(1).
Применяя данную формулу для азота и кислорода, найдём:
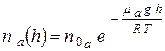 (2) и
(2) и 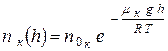 (3).
(3).
Поделив равенства (2) и (3), запишем: 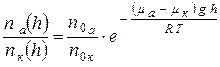 (4).
(4).
По условию 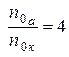 , тогда получим:
, тогда получим: 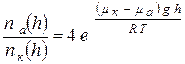 (5).
(5).
Искомая доля кислорода (молярная) в воздухе в районе Цинхай определяется выражением:
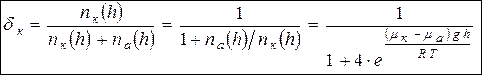 (6).
(6).
Так как 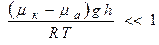 , то:
, то: 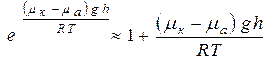 (7).
(7).
С учётом (7) получим искомую величину из выражения (6):
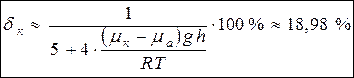 (8).
(8).
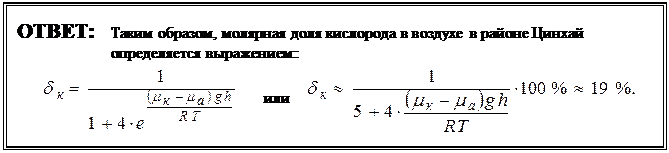 P.S. Интересно отметить, что при восхождении на высоты от 3500 м выше, возникает горная болезнь- насыщение крови кислородом составляет менее 90 %. Начиная с высоты 5800 м, идёт “зона смерти”. Так, например, при восхождении на Эверест (по-тибетски- Джомолунгма “Божественная мать Земли”) самую высокую (8848 м) гору из 14 –ти “восьмитысячников” нашей планеты, альпинисты обязательно берут с собой титановый баллончик с кислородом, поскольку на вершине Эвереста плотность воздуха уменьшается почти в три раза.
P.S. Интересно отметить, что при восхождении на высоты от 3500 м выше, возникает горная болезнь- насыщение крови кислородом составляет менее 90 %. Начиная с высоты 5800 м, идёт “зона смерти”. Так, например, при восхождении на Эверест (по-тибетски- Джомолунгма “Божественная мать Земли”) самую высокую (8848 м) гору из 14 –ти “восьмитысячников” нашей планеты, альпинисты обязательно берут с собой титановый баллончик с кислородом, поскольку на вершине Эвереста плотность воздуха уменьшается почти в три раза.
Задача № 58 (6 баллов ) Решение: (РОФ, 2009)
А) Если 0 < 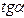 <
< 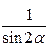 ., то
., то 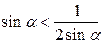 . Тогда
. Тогда 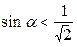 . Следовательно, угол α не больше 45 0 , а значит
. Следовательно, угол α не больше 45 0 , а значит 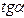 < 1. По условию
< 1. По условию 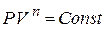 или
или 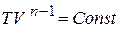 . Таким образом, температура с увеличением объёма растёт по закону
. Таким образом, температура с увеличением объёма растёт по закону 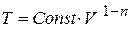 , где n < 1.
, где n < 1.
B) Выяснив, что 0 < n < 1, можно прийти к ответу, рассуждая следующим образом:
Кривые процесса 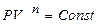 идут, при указанных значениях n на графике зависимости P от V, более полого, чем проведённые через первоначальную точку изотермы
идут, при указанных значениях n на графике зависимости P от V, более полого, чем проведённые через первоначальную точку изотермы 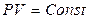 . Следовательно, при расширении газа по этому закону давление падает медленнее, чем при изотермическом процессе расширения газа. Таким образом – газ нагревается!
. Следовательно, при расширении газа по этому закону давление падает медленнее, чем при изотермическом процессе расширения газа. Таким образом – газ нагревается!

Задача № 59 (5 баллов ) Решение: (РОФ, 2004)
Температура оболочки падающего метеорита равна в первом приближении температуре “воздушной подушки” перед метеоритом. Нагрев воздуха вызван в основном его быстрым сжатием.
Так как процесс сжатия очень быстрый, то его можно считать адиабатическим. Из уравнения Пуассона следует, что
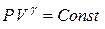 (1), где показатель адиабаты
(1), где показатель адиабаты 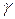 связан с числом степеней свободы газа i (для воздуха, состоящего в основном из двухатомных газов- азота (78 %) и кислорода (21 %) i = 5) следующим выражением:
связан с числом степеней свободы газа i (для воздуха, состоящего в основном из двухатомных газов- азота (78 %) и кислорода (21 %) i = 5) следующим выражением: 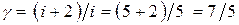 (2).
(2).
Пренебрегая краевыми эффектами (воздух частично успевает огибать края огромного метеорита), запишем в соответствии с законом Менделеева - Клапейрона: 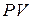 ~
~ 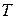 (3). Таким образом, исключая
(3). Таким образом, исключая 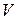 из (1)–(3), получим:
из (1)–(3), получим: 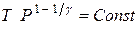 (4) или
(4) или  (5).
(5).
Отсюда окончательно найдём температуру 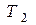 на поверхности падающего метеорита:
на поверхности падающего метеорита:
 |
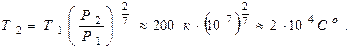
|
|
|
|
|
Дата добавления: 2014-12-08; Просмотров: 596; Нарушение авторских прав?; Мы поможем в написании вашей работы!