
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фазовые переходы первого рода. Плавление. Испарение
|
|
|
|
Фазовые переходы, характеризующиеся равенством изобарных потенциалов двух сосуществующих в равновесии фаз и скачкообразным изменением первых производных по энергии Гиббса (энтропии и объема) при переходе вещества из одной фазы в другую, называются фазовыми переходами первого рода. К нимотносятся агрегатные превращения — плавление, испарение, возгонка и др.
При фазовых переходах первого рода скачкообразно могут изменяться и вторые производные от энергии Гиббса.
В системах с фазовыми переходами первого рода энергия Гиббса каждой из фаз
(G1 и G2) выражается различными функциями термодинамических параметров. Зависимости G1 и G2 от температуры в таких системах показаны на рис.9. Кривые G1 = f(T) и G2 = f(T) пересекаются при температуре фазового перехода Tфаз.пр., при которой G1 = G2. и dG = 0. При Т < Tфаз.пр. устойчивой является фаза 1, т. к. G1 < G2, а при Т > Tфаз.пр. более устойчивой является фаза 2, т. к. G1 > G2.
При фазовых переходах первого рода функции G1 = f(T) и G2 = f(T) в точке фазового перехода не имеют математических особенностей, и кривые этих функций продолжаются в обе стороны от этой точки (пунктирные кривые на рис.9).
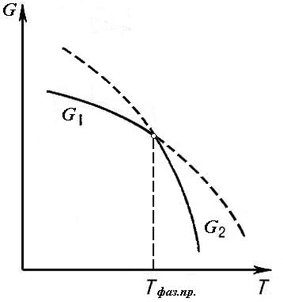
Рис. 9. Зависимость энергии Гиббса системы от температуры при фазовом переходе первого рода.
Это значит, что в системах с фазовыми переходами первого рода имеется возможность существования метастабильных состояний (т. е., состояний неустойчивого равновесия физической системы, в которых система может находиться длительное время), например, переохлажденного (пересыщенного) пара или перегретой жидкости. Такие состояния иногда наблюдаются при медленном переходе через температуру Tфаз.пр..
Из фазовых переходов первого рода рассмотрим подробнее плавление и испарение, представляющие более общий интерес, чем другие процессы.
Плавление. Теплота плавления — перехода твердой фазы в жидкую — всегда положительна. Объём (мольный, удельный) жидкой фазы (Vж = V 2)в общем случае может быть больше или меньше объёма того же количества твердой фазы (Vт = V 1). Из этого в соответствии с уравнением (IV, 5) вытекает, что величина dP/dT или обратная ей величина dT/dP, характеризующая изменение температуры с увеличением внешнего давления, может быть положительной или отрицательной. Это значит, что температура плавления может повышаться или понижаться с увеличением внешнего давления.
Так, для бензола (t пл. = 5,4°C; D Hпл. = 9986 Дж / моль; V ж = 87,28´10-6 м 3 /моль; V т = 86,27´10-6 м 3 /моль)получаем по уравнению (IV, 5):
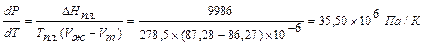
Обратная величина dT/dP = 0,0282´10-6 К/Па. Таким образом, с ростом давления температура плавления бензола повышается.
Величина dT/dP положительна для огромного большинства веществ. Она имеет отрицательное значение лишь для воды, висмута, галлия, германия и немногих других веществ, для которых плотность жидкости при температуре плавления больше плотности твердой фазы и (Vж – Vт) < 0.
Испарение. Теплота испарения — перехода жидкой фазы в газообразную — так же, как и теплота плавления, положительна. В этом случае всегда объём (удельный, мольный) газа больше соответствующего объёма жидкости, т. е. в уравнении (IV, 5) всегда V2 > V1. Поэтому dP/dT, а значит, и dT/dP также всегда положительны. Следовательно, температура испарения всегда повышается с ростом внешнего давления.
При температурах, далеких от критической, плотность насыщенного пара во много раз меньше плотности жидкости, а обратная величина — мольный (удельный) объём пара во много раз больше мольного (удельного) объёма жидкости. Поэтому значением V 1 = V ж в уравнении (IV, 5) можно пренебречь, и оно примет вид:
 (IV, 6)
(IV, 6)
Если вдали от критической температуры насыщенный пар можно считать идеальным газом, то 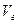 = RT/P,и из уравнения (IV, 5) получим[1]:
= RT/P,и из уравнения (IV, 5) получим[1]:
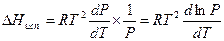 (IV, 7)
(IV, 7)
или
 (IV, 8)
(IV, 8)
Теплота испарения жидкостей изменяется с температурой, не сильно убывая при средних температурах и очень сильно вблизи критической температуры, при которой  = 0. Например, для Н2О:
= 0. Например, для Н2О:
| t °C | |||||||||
 , кал/г , кал/г
| 594,7 | 584,1 | 567,9 | 539,1 | 463,4 | 335,1 | 213,0 | 107,0 | 35,3 |
Таблица 1. Энтальпия и энтропия испарения некоторых жидкостей при нормальной температуре кипения (Р = 1 атм.)
| Вещество | T кип., K | D Hисп., кал/моль | D Sисп. , кал/моль·K |
| Водород | 20,4 | 10,6 | |
| Кислород | 90,1 | 18,0 | |
| Этиловый эфир | 21,1 | ||
| Бензол | 21,2 | ||
| Ртуть | 22,6 | ||
| Вода | 26,0 | ||
| Этиловый спирт | 26,9 |
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 649; Нарушение авторских прав?; Мы поможем в написании вашей работы!