
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Фазовые переходы. Уравнение Клапейрона-Клаузиуса
|
|
|
|
В системе, состоящей из нескольких фаз чистого вещества, находящихся в равновесии, возможны переходы вещества из одной фазы в другую. Такие переходы называются фазовыми переходами.
Рассмотрим равновесный переход одного моля вещества из одной фазы (1) в другую (2), совершающийся при постоянных давлении и температуре. Энергии Гиббса (G 1и G 2) моля вещества в фазах 1 и 2 равны (условие равновесия). Следовательно:
G 2 = G 1 (IV, 1)
Напишем уравнения (III,31) полных дифференциалов для энергии Гиббса одного моля чистого вещества в двух равновесных фазах 1 и 2:
dG 1 = V 1 dP – S 1 dT
dG 2 = V 2 dP – S 2 dT (IV, 2)
Вычитая верхнее уравнение из нижнего, получим:
dG 2 – dG 1 = (V 2 – V 1) dP – (S 2 – S 1) dT
Изменения P и Т здесь были не независимыми, а такими, при которых сохранялось равновесие между фазами 1 и 2. Таким образом, между P и Т сохранялась функциональная связь, соответствующая фазовому равновесию. Поэтому, если G 1 = G 2(равновесие при давлении P и температуре Т), то G 1 + dG 1 = G 2 + dG 2(равновесие при давлении P + dP и температуре T + dT), значит, dG l = dG 2 или dG 2 — dG 1 = 0. Следовательно
(V 2 – V 1) dP – (S 2 – S 1) dT = 0
или
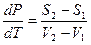 (IV, 3)
(IV, 3)
Взаимное превращение фаз рассматривалось как равновесное и изотермическое, поэтому:
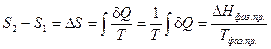 (IV, 4)
(IV, 4)
Здесь  — теплота фазового превращения, поглощаемая или выделяемая при переходе моля вещества из фазы 1 в фазу 2; V 2 – V 1 — разность мольных объёмов двух фаз.
— теплота фазового превращения, поглощаемая или выделяемая при переходе моля вещества из фазы 1 в фазу 2; V 2 – V 1 — разность мольных объёмов двух фаз.
Из уравнений (IV, 3) и (IV, 4) получим:
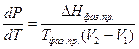 (IV, 5)
(IV, 5)
Уравнение (IV, 5) называется уравнением Клапейрона - Клаузиуса и является общим термодинамическим уравнением, приложимым ко всем фазовым переходам чистых веществ.
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 659; Нарушение авторских прав?; Мы поможем в написании вашей работы!