
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия Гиббса смеси идеальных газов. Определение химического потенциала
|
|
|
|
Энергия Гиббса является экстенсивной функцией, что позволяет рассчитать ее значение для смеси идеальных газов.
Представим себе резервуар, разделенный перегородками на секции, как показано на рис.8.
В каждую секцию помещают индивидуальный газ, причем все они имеют различную природу. Объем каждой секции равен V 1, V 2.. .Vi, объем всего резервуара равен V = V 1 + V 2 +... + Vi. Число молей каждого газа n 1, n 2.. .ni. Во всех секциях газы имеют одинаковую температуру Т = const и одинаковое давление Р = const.
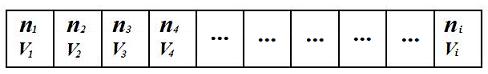
Рис. 8. Резервуар, разделенный на секции и заполненный газами разной природы
при Т = const и Р = const.
До перемешивания газов суммарная энергия Гиббса будет равна сумме энергий Гиббса всех газов, находящихся в отдельных секциях.
После удаления перегородок между секциями газы разной природы самопроизвольным образом перемешиваются вследствие процесса диффузии и все газы равномерно распределяются по объему резервуара V. Каждый газ в полученной смеси будет характеризоваться парциальным давлением Pi, причем P 1 + P 2 +... + Pi = Pобщ..
Из определения энергии Гиббса (III, 18) следует:
G = U + PV – TS
Рассмотрим в этом выражении каждое слагаемое.
Согласно уравнению (I, 28) зависимость внутренней энергии 1 моль индивидуального i - ого вещества от температуры представляется следующим образом:
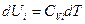 (III, 43)
(III, 43)
где CVi — молярная теплоёмкость при постоянном объёме i - ого газа. Так как для идеального газа теплоёмкость CVi не зависит от температуры, интегрируя при этом условии уравнение (III, 43) от нуля до Т, получим:
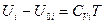 или
или 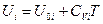 (III, 44)
(III, 44)
где U 0 i — внутренняя энергия 1 моль i - ого вещества при 0 К. Если в смеси этого вещества содержится ni моль, то умножая обе части уравнения (III, 44) на ni и суммируя по всем индивидуальным веществам системы, будем иметь:
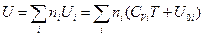 (III, 45)
(III, 45)
Второе слагаемое в выражении для энергии Гиббса, исходя из уравнения Менделеева — Клапейрона, запишем в виде:
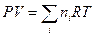 (III, 46)
(III, 46)
Рассмотрим третье слагаемое. Из уравнения (II, 23) для 1 моль идеального газа следует:
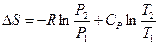
Положим 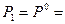 1 атм и T 1 = 1 K, тогда
1 атм и T 1 = 1 K, тогда
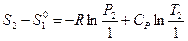 или
или 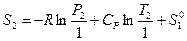 (III, 47),
(III, 47),
где 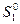 — стандартная (так как относится к P 0 = 1 атм.) энтропия 1 моль идеального газа при 1 К, которая также называется энтропийной постоянной идеального газа. Индекс «2» теперь можно отбросить и выражение запишется в виде:
— стандартная (так как относится к P 0 = 1 атм.) энтропия 1 моль идеального газа при 1 К, которая также называется энтропийной постоянной идеального газа. Индекс «2» теперь можно отбросить и выражение запишется в виде:
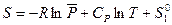 ,
,
где 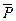 — относительное давление. Стоящие под знаком логарифма величины
— относительное давление. Стоящие под знаком логарифма величины 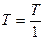 и
и  — безразмерные. Следует отметить, что величины P и P 0 могут быть выражены в любых, но обязательно одних и тех же единицах — атмосферах, паскалях, миллиметрах ртутного столба (торричелли) и т. д. Однако выражение давления в атмосферах имеет очевидное преимущество, т. к. в этом случае давление и относительное давление численно совпадают
— безразмерные. Следует отметить, что величины P и P 0 могут быть выражены в любых, но обязательно одних и тех же единицах — атмосферах, паскалях, миллиметрах ртутного столба (торричелли) и т. д. Однако выражение давления в атмосферах имеет очевидное преимущество, т. к. в этом случае давление и относительное давление численно совпадают 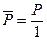 .
.
Таким образом, для 1 моля i - ого компонента газовой смеси мы можем записать:
 (III, 48),
(III, 48),
где 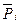 — относительное парциальное давление i - ого компонента.
— относительное парциальное давление i - ого компонента.
Умножив обе части выражения (III, 48) на ni и суммируя по всем индивидуальным веществам в системе, получим:
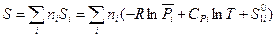 (III, 49)
(III, 49)
Подставив значения U, PV и S из уравнений (III, 45), (III, 46) и (III, 49) в выражение для энергии Гиббса, получаем следующий результат:
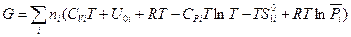 (III, 50)
(III, 50)
Первые пять слагаемых в этом уравнении зависят от природы индивидуального i ‑ ого вещества и температуры, но не зависят от состава смеси и давления. Алгебраическую сумму этих пяти слагаемых, стоящих в скобках, обозначим через 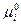 . Тогда
. Тогда
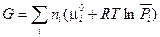 (III, 51)
(III, 51)
или, если ввести обозначение
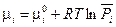 (III, 52)
(III, 52)
то выражение (III, 51) можно окончательно представить в таком виде:
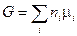 (III, 53)
(III, 53)
Величина 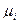 называется химическим потенциалом i - ого вещества, а величина
называется химическим потенциалом i - ого вещества, а величина 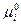 — стандартным химическим потенциалом (при
— стандартным химическим потенциалом (при 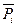 =1) i - ого вещества.
=1) i - ого вещества.
Так как для идеальной газовой смеси 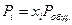 и
и 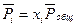 , то уравнение
, то уравнение
(III, 52) можно привести к виду:
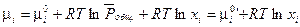 (III, 54)
(III, 54)
где 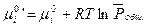 (III, 55)
(III, 55)
Если 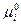 есть функция только температуры, то
есть функция только температуры, то 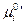 зависит не только от температуры, но и давления.
зависит не только от температуры, но и давления.
Подставив значение m i из уравнения (III, 54) в (III, 53), получим:
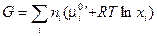 (III, 56)
(III, 56)
Для того, чтобы определить суммарную энергию Гиббса смеси идеальных газов, также следует принять во внимание изменение энергии Гиббса, обусловленное самим процессом смешения:
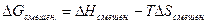
Оно может быть найдено, если принять во внимание, что для идеальных газов 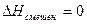 . Ну, а изменение энтропии при смешении нами уже было определено ранее (смотри (II, 26)).
. Ну, а изменение энтропии при смешении нами уже было определено ранее (смотри (II, 26)).
Таким образом,
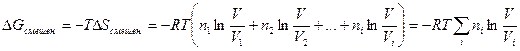
Так как при постоянстве температуры T = const произведение
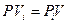 = const, полученное уравнение можно переписать в следующем виде:
= const, полученное уравнение можно переписать в следующем виде:
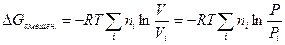
Принимая во внимание, что Р > 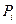 и V >
и V > 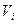 , логарифм отношения этих величин — величина положительная, следовательно,
, логарифм отношения этих величин — величина положительная, следовательно, 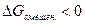 , что полностью соответствует характеристике самопроизвольно протекающих процессов.
, что полностью соответствует характеристике самопроизвольно протекающих процессов.
Итак, для энергии Гиббса смеси идеальных газов окончательно имеем:
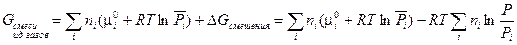
|
|
|
|
|
Дата добавления: 2014-11-29; Просмотров: 1477; Нарушение авторских прав?; Мы поможем в написании вашей работы!