
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Растворы. Растворимость
|
|
|
|
Пояснения к работе
ПРИГОТОВЛЕНИЕ РАСТВОРА ЗАДАННОЙ КОНЦЕТРАЦИИ
ПРАКТИЧЕСКАЯ РАБОТА 3
Оснащение занятия
Оборудование: электронные варианты справочных таблиц и заданий
Задание. Выполните упражнения в расчётах с применением понятия массовая доля сложного вещества»: 1. Рассчитайте массовые доли элементов для каждого из веществ: сульфат меди(11), нитрат железа(111), фосфат кальция(11)
2. Золото пробы 585 содержит 41,5 % меди. Сколько чистого золота содержит кольцо этой пробы массой 2,8 г?
3.Вычислите массовую долю (в %) кислорода в следующих соединениях:
а) HNO3 б Ag2O в) KOH г) Ca3(PO4)2
4. В каком количестве вещества Na2SO4 содержится: а) натрия 24 г б) серой массой 96 г
в) кислорода массой 128 г?
5. Сколько граммов кислорода содержится в 120 г: а) MgO б) NaOH в) FeSO4?
6.сколько грамм железа находится в 5 моль: а) Fe2O3 б) Fe(OH)2 в) FeSO4?
Содержание отчёта Запишите в журнал лабораторно-практических занятий: 1.Название практической работы 2. Задание 3. Условие индивидуального задания и его решение
Контрольные вопросы для самопроверки 1.Сформулируйте закон постоянства состава вещества 2.Кем и когда был сформулирован закон сохранения массы вещества?
3.Как на практике используются законы постоянства состава и сохранения массы вещества?
4.Что выражает химическая формула?
5. Как рассчитать массовую долю элемента в сложном веществе?
Список литературы и интернет - источников
Учебник О.С. Габриелян для СПО, 2008, с. 59 -60
Цель работы: Приготовление трёх растворов заданной концентрации,
путём растворения твёрдого вещества в воде, разбавления
раствора и добавления твёрдого вещества к имеющемуся
раствору
Знать: понятия растворимость, концентрация растворов, массовая
доля вещества
Уметь: производить расчёты на концентрацию растворов; готовить растворы заданной
концентрации
Растворимость (при данных условиях) – масса порции растворённого вещества, которую при данных температуре и давлении необходимо растворить в 100 г растворителя для приготовления насыщенного раствора.
Относительное содержание растворённого вещества в растворе называют концентрацией раствора.
Свойства растворов зависят не только от свойств растворителя и растворённого вещества, но и от относительного их содержания, то есть от концентрации раствора.
. Количественный состав ненасыщенных растворов выражают несколькими способами, в том числе массовой долей растворённого вещества.
Массовой долей (W) растворённого вещества Х называют отношение массы растворённого вещества к общей массе раствора.
Массовая доля является безразмерной величиной, её выражают в долях или процентах
w(x) =  ; w(x) =
; w(x) =  100%,
100%,
где w(x) – массовая доля растворенного вещества;
m(x) – масса растворенного вещества;
m(р-ра) – общая масса раствора
Пример расчета: Задача 1.Определите массовую долю (в %) КОН в растворе, если КОН
массой 40 г растворен в воде массой 160 г
Решение: Общая масса раствора КОН равна
т (р-ра) = т (КОН) + т (Н 2 О)
т (р-ра) = 160г + 40г = 200г
Подставляя известные величины в формулу, получаем
W(КОН) = 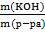 100% =
100% = 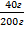 100%=20%
100%=20%
Задача 2. Приготовьте 50 г 10%-го раствора KNO3
Решение:
m(KNO3) = 50г х 0,1 = 5г
m(H2O) = 50 г – 5г = 45г
p(H2O) = 1г/мл, V(H2O) = 45мл Следовательно, требуется взять навеску KNO3 массой 5 г и добавить 45мл воды
|
|
|
|
|
Дата добавления: 2014-12-16; Просмотров: 976; Нарушение авторских прав?; Мы поможем в написании вашей работы!