
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні формули. Кількість речовини тіла (системи)
|
|
|
|
МОЛЕКУЛЯРНА ФІЗИКА ТА ТЕРМОДИНАМІКА.
Кількість речовини тіла (системи) 
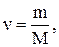 (2.1)
(2.1)
де m – маса тіла m – молярна маса.
Кількість структурних елементів (атомів, молекул і т.п.) у тілі (системі)
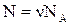 (2.2)
(2.2)
де 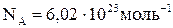 – постійна Авогадро.
– постійна Авогадро.
Рівняння стану ідеального газу (рівняння Менделєєва – Клапейрона)
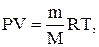 або
або 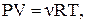 (2.3)
(2.3)
де P – тиск газу, V – його об’єм; m – маса газу; M– молярна маса газу; R = 8,31 Дж / (моль × K) – універсальна газова стала; T – термодинамічна температура.
T = 273 + t (2.4)
де t – температура за шкалою Цельсія.
Окремі випадки рівняння стану (ізопроцеси):
а) закон Бойля – Маріотта (ізотермічний процес, T = const, m = const)
PV = const, або 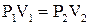 (2.5)
(2.5)
б) закон Гей – Люссака (ізобаричний процес, P = const)
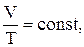 або
або 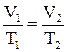 (2.6)
(2.6)
в) закон Шарля (ізохоричний процес, V = const)
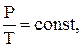 або
або 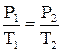 (2.7)
(2.7)
Тиск у суміші газів визначається за законом Дальтона.
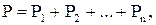 (2.8)
(2.8)
де 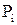 – парціальний тиск окремих компонентів, n – кількість компонентів.
– парціальний тиск окремих компонентів, n – кількість компонентів.
Концентрація молекул речовини у будь-якому стані
 або
або 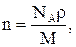 (2.9)
(2.9)
де N – кількість молекул, які містяться у даній системі; V – об’єм тіла або системи; r - густина речовини; M– молярна маса речовини.
Основне рівняння кінетичної теорії газів
 (2.10)
(2.10)
де n – концентрація молекул,  – середня кінетична енергія молекули.
– середня кінетична енергія молекули.
Для одноатомної молекули

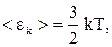 (2.11)
(2.11)
де  – постійна Больцмана; T – термодинамічна температура.
– постійна Больцмана; T – термодинамічна температура.
Для багатоатомної молекули
 (2.12)
(2.12)
де і – кількість ступенів свободи молекули.
Зв’язок тиску газу з концентрацією і температурою
p = nkT (2.13)
Швидкість руху молекул:
 – середня квадратична, (2.14)
– середня квадратична, (2.14)
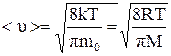 – середня арифметична, (2.15)
– середня арифметична, (2.15)
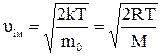 – найбільш ймовірна, (2.16)
– найбільш ймовірна, (2.16)
де 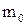 – маса однієї молекули.
– маса однієї молекули.
Середня довжина вільного пробігу молекули
 (2.17)
(2.17)
де s – ефективний діаметр молекули; n – концентрація молекул.
Середнє число зіткнень кожної молекули з іншими в одиницю часу
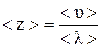 (2.18)
(2.18)
Молярні теплоємності газу при постійному об’ємі ( ) і при постійному тиску (
) і при постійному тиску ( ):
):

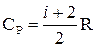 (2.19)
(2.19)
Згідно з рівнянням Роберта Майєра
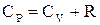 (2.20)
(2.20)
Зв’язок між молярною (С) і питомою (с) теплоємностями
 (2.21)
(2.21)
Перше начало термодинаміки
Q = DU + A (2.22)
де Q – теплота яку надано системі; DU – зміна внутрішньої енергії системи; A – робота системи проти зовнішніх сил.
Внутрішня енергія ідеального газу
 (2.23)
(2.23)
Робота розширення газу у загальному випадку
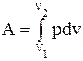 (2.24)
(2.24)
Окремі випадки:
а) ізобаричний процес: 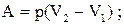 (2.25)
(2.25)
б) ізотермічний процес: 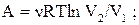 (2.26)
(2.26)
в) адіабатичний процес (який відбувається без теплообміну з оточуючим середовищем, Q = 0):
 (2.27)
(2.27)
де  – молярна теплоємність при постійному об’ємі;
– молярна теплоємність при постійному об’ємі;
 – коефіцієнт Пуассона.
– коефіцієнт Пуассона.
При адіабатичному процесі параметри стану зв’язані рівняннями:
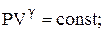
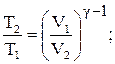
 (2.28)
(2.28)
Термодинамічний коефіцієнт корисної дії (к.к.д.) теплової машини
 або
або  (2.29)
(2.29)
де  – теплота, яку отримало робоче тіло машини за один цикл;
– теплота, яку отримало робоче тіло машини за один цикл;
 – теплота, яку робоче тіло віддало за цикл;
– теплота, яку робоче тіло віддало за цикл;
 – робота, яку виконало робоче тіло за цикл.
– робота, яку виконало робоче тіло за цикл.
Для циклу Карно
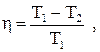 (2.30)
(2.30)
де 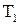 – температура нагрівача,
– температура нагрівача, 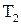 – температура охолоджувача.
– температура охолоджувача.
Зміна ентропії для елементарного процесу
 (2.31)
(2.31)
де  – кількість отриманої системою тепла; T – температура, при якій відбувається теплопередача.
– кількість отриманої системою тепла; T – температура, при якій відбувається теплопередача.
При наявності у просторі градієнтів температури, густини речовини, або якщо межують шари рідини або газу, що рухаються з різними швидкостями, виникають процеси по вирівнюванню цих неоднорідностей (явища переносу).
У одномірному випадку вони відбуваються за законами
а) для теплопровідності: 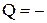 c
c  (2.32)
(2.32)
де Q – кількість теплоти, перенесена за час Dt крізь площадку DS;
DT/DX – градієнт температури у напрямку, перпендикулярному до DS;
c – коефіцієнт теплопровідності.
б)для дифузії:  (2.33)
(2.33)
M – маса, перенесена за час Dt крізь площадку DS,
 – градієнт густини у напрямку, перпендикулярному до площадки; D – коефіцієнт дифузії.
– градієнт густини у напрямку, перпендикулярному до площадки; D – коефіцієнт дифузії.
в) для внутрішнього тертя (в’язкості):
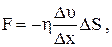 (2.34)
(2.34)
де F – сила внутрішнього тертя; Du/Dx – градієнт швидкості течії газу у напряму, перпендикулярному до DS; h – коефіцієнт внутрішнього тертя (динамічна в’язкість).
Для коефіцієнтів справедливі співвідношення

 c
c  (2.35)
(2.35)
Окремі випадки розподілу Гіббса:
а) розподіл молекул по швидкостям (закон Максвелла)
 (2.36)
(2.36)
де DN – кількість молекул, відносні швидкості яких лежать в інтервалі від u до u + Du;  – відносна швидкість, u – швидкість молекули і
– відносна швидкість, u – швидкість молекули і
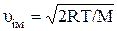 – найбільш імовірна швидкість молекул;
– найбільш імовірна швидкість молекул;
N – загальне число молекул;
При розв’язуванні задач на розподіл молекул по швидкостям зручно використовувати таблицю (1)
Таблиця 2.1
| U | 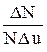
| U | 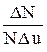
| U | 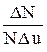
|
| 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 | 0,02 0,09 0,18 0,31 0,44 0,57 0,68 0,76 | 0,9 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 | 0,81 0,83 0,82 0,78 0,71 0,63 0,54 0,46 0,36 | 1,8 1,9 2,0 2,1 2,2 2,3 2,4 2,5 | 0,29 0,22 0,16 0,12 0,09 0,06 0,04 0,03 |
б) барометрична формула (у припущенні, що температура в усіх точках однакова) дає залежність тиску газу від висоти h в полі сили тяжіння
 (2.37)
(2.37)
де  – тиск на висоті h = 0; g – прискорення сили тяжіння.
– тиск на висоті h = 0; g – прискорення сили тяжіння.
Рівняння стану реального газу (рівняння Ван-дер-Ваальса) для одного моля
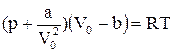 (2.38)
(2.38)
де 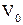 – об’єм моля; a і b – постійні, які залежать від природи газу.
– об’єм моля; a і b – постійні, які залежать від природи газу.
Рівняння для будь-якої кількості газу
 (2.39)
(2.39)
Постійні a і b зв’язані з критичними параметрами співвідношеннями

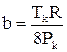 (2.40)
(2.40)
|
|
|
|
|
Дата добавления: 2015-01-03; Просмотров: 371; Нарушение авторских прав?; Мы поможем в написании вашей работы!