
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Транспозиция магистральных сосудов
|
|
|
|
Транспозиция магистральных сосудов – врождённый порок, при котором аорта начинается от морфологически правого желудочка, а лёгочная артерия – от морфологически левого желудочка. Среди новорождённых с пороками сердца, на долю описываемой аномалии приходится около 10%. Это заболевание по частоте
 уступает только тетраде Фалло. Транспозиция магистральных сосудов (ТМС) является одним из наиболее тяжёлых врождённых пороков сердца. Половина детей погибает в течение первого месяца после рождения, 89-95% не доживает до годовалого возраста. Поэтому большинство операций при данном пороке носят неотложный характер.
уступает только тетраде Фалло. Транспозиция магистральных сосудов (ТМС) является одним из наиболее тяжёлых врождённых пороков сердца. Половина детей погибает в течение первого месяца после рождения, 89-95% не доживает до годовалого возраста. Поэтому большинство операций при данном пороке носят неотложный характер.
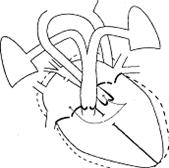
Рис. 30. Схема транспозиции магистральных сосудов
Классификация. Выделяют несколько форм ТМС.
Наиболее тяжёлая форма носит название «простой», или «полной» (рис. 30). В этом случае, как было сказано выше, аорта с коронарными артериями отходит от правого желудочка, лёгочная артерия – от левого. Таким образом, оба круга кровообращения оказываются разобщёнными: большой круг кровообращения получает венозную кровь, малый круг – артериальную. Жизнь при таком пороке возможна короткое время – до тех пор, пока сохраняются сообщения между кругами кровообращения, существующие у плода (открытый артериальный проток между аортой и лёгочной артерией и открытое овальное окно между предсердиями). В первые несколько дней жизни сброс оксигенированной крови в аорту по ОАП происходит благодаря естественно высокому лёгочному сопротивлению и мощности сокращений левого желудочка. Через некоторое время, на второй - третьей неделе жизни, за счёт снижения лёгочного сопротивления поток оксигенированной крови по ОАП уменьшается. Соответственно, большая часть крови, насыщенной кислородом, повторно поступает в «малый круг» и левое предсердие. В этих условиях смешивание крови между кругами кровообращения осуществляется через открытое овальное окно, от пропускной способности которого зависит жизнь больного.
Немного стабильнее состояние больных, имеющих сочетанную форму ТМС, когда одновременно имеется ДМЖП (или единый желудочек), особенно при сочетании ТМС с большим ДМЖП и стенозом лёгочной артерии. Большой септальный дефект обеспечивает хорошее смешивание крови, а умеренный стеноз устья лёгочной артерии предохраняет пациента от отёка лёгких. Возможны другие сочетания ТМС: с атриовентрикулярной коммуникацией, аномальным дренажем лёгочных вен, коарктацией аорты.
Отдельно выделяется корригированная (от рождения) ТМС, при которой меняются местами не только магистральные сосуды, но и желудочки. В этом случае правое предсердие сообщается с левым желудочком, от которого отходит лёгочная артерия, а левое предсердие – с правым желудочком и отходящей от него аортой. Как видим, такой сложный порок не нарушает кровообращения по большому и малому кругам кровообращения. До последнего времени считалось, что хирургические операции при корригированной ТМС не нужны. Вместе с тем,
накапливаются данные о том, что у взрослых с корригированной ТМС постепенно развивается недостаточность правого желудочка, не приспособленного к прокачиванию крови по большому кругу кровообращения. Вопрос о необходимости хирургического лечения корригированной ТМС остается открытым.
Клинические проявления. Поскольку ТМС не влияет на развитие плода, оксигенация крови которого происходит через плаценту, дети с этим пороком, как правило, рождаются доношенными, с нормальным весом тела.
Сразу же после рождения у больных появляется выраженный цианоз. Нижняя половина тела менее цианотична, чем верхняя (вследствие притока оксигенированной крови в нисходящую аорту через ОАП). Шумовая картина у новорождённого скудна (выслушивается лёгкий систолический шум на основании сердца, обусловленный ОАП). Признаки сердечной недостаточности (одышка, тахикардия, увеличение размеров сердца, гепатомегалия, отёки, асцит) у новорождённых могут отсутствовать: они появляются позже. Ключевым моментом диагностики является проба с кислородом (ингаляция в течение 15-20 минут), позволяющая дифференцировать сердечный цианоз от лёгочного, травматического, метаболического и т.д. Как известно, ингаляция кислорода, повышая оксигенацию крови в малом круге кровообращения, вызывает спазм ОАП. Поскольку у больных с ТМС от пропускной способности ОАП зависит перемешивание крови между кругами кровообращения, ингаляция кислорода ухудшает состояние ребёнка, усиливая цианоз. Напротив, при цианозе некардиального происхождения, насыщение крови кислородом увеличивается.
Электрокардиография:
отклонение электрической оси сердца вправо.
Рентгенологическое исследование:
нормальный лёгочный рисунок или венозный застой. Форма сердца шарообразная, с узким сосудистым пучком.
 Эхокардиография – основной метод диагностики ТМС, позволяющий увидеть особенности порока, важные для планирования операции (варианты строения коронарных артерий, размеры желудочков, состояние клапанного аппарата сердца и т.д.).
Эхокардиография – основной метод диагностики ТМС, позволяющий увидеть особенности порока, важные для планирования операции (варианты строения коронарных артерий, размеры желудочков, состояние клапанного аппарата сердца и т.д.).
Рис. 31. ЭХО-КГ картина ТМС. Обозначения: ЛЖ – левый желудочек, ПЖ – правый желудочек, ЛС – лёгочной ствол, Ао – аорта.
Зондирование сердца и ангиокардиография в последние годы перестали быть основным диагностическим мероприятием. Как правило, они выполняются в диагностически сложных случаях, а также в ходе паллиативного эндоваскулярного вмешательства – атриосептотомии.
Выявляются:
- отхождение аорты от правого, а лёгочной артерии от левого желудочка;
- расположение аорты кпереди от лёгочной артерии;
 - повышение давления в левом желудочке при стенозе лёгочной артерии и ДМЖП;
- повышение давления в левом желудочке при стенозе лёгочной артерии и ДМЖП;
- заброс контрастного вещества из правого желудочка в левый при наличии ДМЖП.
Лечение
1. Если проба с ингаляцией кислорода подтверждает ТМС, необходимо отменить оксигенотерапию и начать введение простагландина Е1 (алпростан, простин, вазопростан), поддерживающего функцию ОАП. Продолжая терапию простагландином, транспортируют ребёнка в отделение кардиохирургии.
2. Вслед за этим, проводят ургентные паллиативные операции, направленные на улучшение перемешивания крови между кругами кровообращения. Это достигается путём расширения отверстия в межпредсердной перегородке. Возможна эндоваскулярная атриосептотомия специальным баллоном, расширяющим овальное окно (т.н. «процедура Рашкинда»). При неэффективности эндоваскулярного вмешательства может быть выполнена открытая операция по иссечению межпредсердной перегородки (операция Блелока-Хенлона). Паллиативные операции позволяют ребёнку пережить критический период. Тем не менее, вслед за ними должны выполняться радикальные операции (поскольку пятилетняя выживаемость после паллиативных операций немногим более 50%).
3. Операции по внутрипредсердному переключению кровотока (Мастарда и Сенинга). Несмотря на технические различия, суть вмешательств состоит в том, чтобы кровь из лёгочных вен поступала в правые отделы сердца и отходящую от них аорту, а кровь из полых вен – в левые отделы сердца и лёгочную артерию. Вмешательства могут осложняться обструкцией лёгочных или системных вен, нарушениями ритма сердца, дисфункцией правого желудочка и трикуспидального клапана. Пятилетняя выживаемость после них составляет 81%.
4. В настоящее время радикальной операцией выбора является артериальное переключение по Жатене, заключающаяся в перемещении аорты и коронарных артерий в левый желудочек, а лёгочной артерии – в правый.
ОТКРЫТЫЙ АТРИОВЕНТРИКУЛЯРНЫЙ КАНАЛ (ОАВК)
Термин ОАВК – это комбинированный врождённый порок, при котором имеются сообщения между предсердиями и желудочками, обусловленные ДМПП и ДМЖП, а также расщеплением створок митрального и трикуспидального клапанов.
Заболевание также называется атриовентрикулярной коммуникацией (АВК). В МКБ-10 оно обозначено как дефект предсердно-желудочковой перегородки.
Статистика. ОАВК встречается в 4% всех ВПС, в половине из них сочетается с синдромом Дауна. Наибольшее значение имеет так называемая
полная форма порока, при которой летальность без хирургического лечения на протяжении первого года жизни составляет 63%.
Анатомическая классификация:
1. Неполная (частичная) форма ОАВК.
2. Полная форма ОАВК.
НЕПОЛНАЯ ФОРМА ОАВК
Неполная форма ОАВК – это дефект первичной межпредсердной перегородки, сочетающийся с расщеплением передней (перегородочной) створки митрального клапана. Значительно реже при неполной форме ОАВК встречается расщепление перегородочной створки трикуспидального клапана.
Порок встречается в 70% случаев всех типов ОАВК.
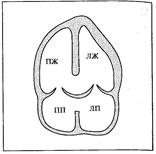
Рис. 32. Схема ОАВК
Гемодинамика (рис. 32).
Артерио-венозный сброс при неполной форме ОАВК происходит на уровне предсердий и одновременно через расщеплённую створку митрального клапана из левого желудочка в левое предсердие. Всё же нарушения гемодинамики близки к таковым при дефекте межпредсердной перегородки: характерна значительная перегрузка правых камер сердца. Перегрузка левых камер сердца – за счёт митральной недостаточности – выражена в меньшей степени. Это объясняется умеренным характером митральной недостаточности, поскольку расщеплена только одна створка клапана.
Лёгочная гипертензия связана как с увеличением притока крови в малый круг кровообращения (за счёт ДМПП), так и с затруднением оттока крови в перегруженное левое предсердие.
Клиника, диагностика
Порок в 3 раза чаще встречается у лиц женского пола. Клиника зависит от размеров ДМПП и от степени выраженности митральной недостаточности. При умеренной недостаточности митрального клапана (МК) клиника почти идентична изолированному ДМПП. При значительной регургитации через расщеплённую створку состояние больных тяжёлое.
Больные жалуются на частые респираторные заболевания, одышку при физической нагрузке. Дети отстают в физическом развитии. Верхушечный толчок усилен, у некоторых больных определяется систолическое дрожание над верхушкой сердца.
Границы сердца увеличены влево.
Аускультация. Выслушиваются два шума, разных по локализации и тембру:
- на верхушке – систолический шум недостаточности МК, который проводится в левую подмышечную область,
- во II-III межреберьях слева от грудины – систолический шум ДМПП,
- второй тон над лёгочной артерией может быть усиленным или расщеплённым.
ЭКГ. Электрическая ось сердца отклонена влево. В грудных отведениях фиксируются признаки перегрузки правого предсердия и обоих желудочков.
Рентгенологически
1. Усилен сосудистый рисунок лёгких, умеренно выбухает дуга лёгочной артерии,
2. В косых проекциях – признаки увеличения обоих желудочков и правого предсердия,
 3 При флюороскопии сердца определяется «симптом коромысла» между 3 и 4 дугами (признак митральной недостаточности).
3 При флюороскопии сердца определяется «симптом коромысла» между 3 и 4 дугами (признак митральной недостаточности).
Эхокардиография. В В-режиме отчётливо видны ДМПП, расщепление передней створки митрального клапана, аномалии её прикрепления (рис. 33). При цветном допплеровском картировании выявляется поток митральной регургитации и направление сброса крови через ДМПП. По регургитации на трёхстворчатом клапане вычисляют степень лёгочной гипертензии.
Рис. 33. ЭХО-КГ картина неполной формы ОАВК (четырёхкамерная позиция).
Катетеризация сердца
1. Зонд легко проходит из правого предсердия через ДМПП в левое предсердие и левый желудочек.
2. Выявляется повышение оксигенации крови на уровне правого предсердия и увеличивается дальше в правом желудочке и лёгочной артерии.
3. Общелёгочное сопротивление и показатели давления нормальные или несколько повышены.
4. Обнаруживается функциональный стеноз между лёгочной артерией и правым желудочком.
При левосторонней вентрикулографии выявляется типичный признак АВК – сужение и деформация путей оттока из левого желудочка (симптом гусиной шеи), свидетельствующий о расщеплённой створке МК. Контраст из левого желудочка поступает в правое и левое предсердие.
Дифференциальный диагноз
Неполную форму ОАВК дифференцируют с дефектом межпредсердной перегородки, митральной недостаточностью, хроническим миокардитом с кардиомегалией, ОАП.
Показания к операции. Оптимальный возраст для операции 6-10 лет. Противопоказанием к операции является острый бактериальный эндокардит.
Послеоперационная летальность при изолированном пороке 3,7-6,7%. При сочетании с другими пороками – 14%.
Операция заключается в пластике ДМПП и створок клапана.
ПОЛНАЯ ФОРМА ОАВК
Определение порока:
1. «Первичный» ДМПП в сочетании с высоким ДМЖП.
2. Отсутствие деления на правое и левое венозное отверстие (общее фиброзное кольцо).
3.Полное расщепление передне-медиальной створки митрального клапана и септальной трикуспидального клапана (рис. 34).
 Рис. 34. Схема предсердно-желудочкового клапанного аппарата при полной форме ОАВК. Обозначения: в результате расщепления, створки митрального клапана превращаются в левую верхнюю (ЛВ), левую нижнюю (ЛН), левую латеральную (ЛЛ). Вместо трикуспидального клапана имеются передне-верхняя (ПВ), передне-нижняя (ПН) и передняя латеральная (ПЛ) створки. Таким образом, вместо отдельных отверстий митрального и трикуспидального клапана, имеется единое отверстие, соединяющее предсердия и желудочки.
Рис. 34. Схема предсердно-желудочкового клапанного аппарата при полной форме ОАВК. Обозначения: в результате расщепления, створки митрального клапана превращаются в левую верхнюю (ЛВ), левую нижнюю (ЛН), левую латеральную (ЛЛ). Вместо трикуспидального клапана имеются передне-верхняя (ПВ), передне-нижняя (ПН) и передняя латеральная (ПЛ) створки. Таким образом, вместо отдельных отверстий митрального и трикуспидального клапана, имеется единое отверстие, соединяющее предсердия и желудочки.
Частота порока - 4,7 - 6,5%.
Гемодинамика. При полной форме ОАВК все камеры сердца сообщаются между собой, поэтому изменения гемодинамики обусловлены сочетанием нарушений как при больших ДМПП и ДМЖП и дополняются недостаточностью атриовентрикулярных клапанов. Из-за большого лево-правого сброса возникает объёмная перегрузка правых камер сердца. Рано возникает и быстро прогрессирует лёгочная гипертензия.
Клиника, диагностика. В первые же дни после рождения наблюдается тяжёлое клиническое течение.
Жалобы – на снижение аппетита, утомляемость при кормлении. Больные отстают в физическом развитии, отмечаются повторные пневмонии, раннее развитие "сердечного горба". Признаки сердечной недостаточности в виде тахипноэ, тахикардии, застойных хрипов, увеличение печени. Сердечная недостаточность как у детей, так и взрослых плохо поддаётся медикаментозной терапии.
Пальпация – систолическое дрожание в IV межреберьи слева и на верхушке.
Перкуссия. При выраженном нарушении гемодинамики границы сердца увеличены вправо и влево.
Аускультация. Первый тон в проекции трёхстворчатого клапана усилен, второй тон усилен и расщеплён. Вдоль левого края грудины с эпицентром в третьем-четвертом межреберьях выслушивается грубый, продолжительный систолический шум недостаточности митрального клапана, который проводится в левую подмышечную область.
ЭКГ – электрическая ось сердца отклонена влево, угол альфа равен 90°. Регистрируются ЭКГ-симптомы перегрузки левого предсердия и левого желудочка: расширен двугорбый зубец Р II, V5-6. Увеличен отрицательный зубец P V1, высокий R V5-6, желудочковый комплекс типа qR. Неполная блокада правой ножки пучка
Гиса. При резко выраженной гипертензии малого круга кровообращения преобладает перегрузка правых отделов сердца. У половины больных регистрируется замедление атриовентрикулярной проводимости.
У взрослых больных появляется мерцание предсердий, экстрасистолия.
 Рентгенологическое исследование. Сосудистый рисунок лёгких усилен. Тень сердца увеличена за счёт всех камер сердца, особенно за счёт левого предсердия и правых отделов. При сочетании порока со стенозом лёгочной артерии – конфигурация сердца как при тетраде Фалло.
Рентгенологическое исследование. Сосудистый рисунок лёгких усилен. Тень сердца увеличена за счёт всех камер сердца, особенно за счёт левого предсердия и правых отделов. При сочетании порока со стенозом лёгочной артерии – конфигурация сердца как при тетраде Фалло.
Эхокардиография.
Видны дефекты межпредсердной и межжелудочковой перегородки, а также единая передняя атриовентрикулярная створка (рис. 35).
Катетеризация полостей сердца. Определяется большой сброс крови слева направо, снижение содержания кислорода в крови артерий большого круга, повышение давления в малом круге кровообращения (часто достигающее уровня системного).
Рис. 35. ЭХО-КГ картина полной формы ОАВК (четырёхкамерная позиция).
Дифференциальный диагноз
Порок следует дифференцировать от всех других изолированных и сочетанных пороков, имеющих признаки большого сброса слева направо и высокую лёгочную гипертензию уже в раннем детском возрасте (большого ДМЖП, особенно в сочетании с ОАП или ДМПП, транспозиции магистральных сосудов, единого желудочка сердца).
Показания к операции: вмешательство необходимо уже в раннем детском возрасте (от 3-х месяцев до 1 года жизни). Противопоказания: заведомо неоперабельные варианты порока, высокая, необратимая лёгочная гипертензия. В ряде случаев, когда невозможно восстановление клапанного аппарата путём пластики и возникает необходимость в протезировании митрального клапана, операцию можно отложить, оставив ребёнка под строгим контролем (в случае нарастания лёгочной гипертензии проводится операция сужения лёгочной артерии).
Виды операций. Лечение может проводиться как одномоментно, так и в два этапа. При двухэтапном лечении вначале выполняют сужение лёгочного ствола (операцию Альберта-Мюллера). Затем, через 6 мес. – 1,5 года следует радикальная операция, заключающаяся в восстановлении перегородок и клапанов. В некоторых случаях, когда сложное строение папиллярно-хордального аппарата митрального клапана не позволяет выполнить анатомическую коррекцию порока, выполняют операцию Фонтена (полный или частичный обход правых отделов сердца с выключением последних из кровообращения). Сложность операций определяет высокую госпитальную летальность (от 21 до 53%), однако большинство детей, перенесших операцию, остаются живы (пятилетняя выживаемость равна 91%).
КЛАССИФИКАЦИЯ КРИТИЧЕСКИХ СОСТОЯНИЙ ПРИ ВРОЖДЁННЫХ ПОРОКАХ СЕРДЦА У НОВОРОЖДЁННЫХ
Известно более 90 вариантов врождённых пороков сердца и множество их сочетаний. В формировании порока сердца участвуют межпредсердная и межжелудочковая перегородки, 4 сердечных клапана, аорта и лёгочный ствол, лёгочные вены, полые вены, а также коронарное русло. Изолированное неправильное развитие одного элемента или же их сочетание в совокупности даёт громадное количество вариантов пороков. Поэтому их диагностика врачами общей сети (акушеры, неонатологи, педиатры) представляет собой большую проблему и ведёт к потере драгоценного времени.
Существует множество классификаций врождённых пороков сердца, такие как синие и бледные пороки; с обогащением малого круга кровообращения и с обеднением его. Но ни одна из них не является совершенной, поскольку не только объединяет в группы различные по анатомии пороки, но и не определяет хирургической и терапевтической тактики. На наш взгляд, у детей с ВПС раннего возраста чрезвычайно важным является прогнозирование возможных неотложных состояний. С целью стандартизации возможных вариантов развития заболевания предложена следующая классификация критических состояний (Миролюбов Л.М., Калиничева Ю.Б., 2002).
Рассмотрим отдельные состояния и синдромы, к которым они приводят подробнее.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 2840; Нарушение авторских прав?; Мы поможем в написании вашей работы!