
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ol — V2X 2 страница
|
|
|
|
Выведенные нами неравенства являются условиями равновесия. Их выполнение, однако, еще недостаточно для того, чтобы равновесие было полностью устойчивым.
Именно, могут существовать такие состояния, при бесконечно малом отклонении от которых энтропия уменьшается, так что тело вслед за этим возвращается в исходное состояние, в то время как при некотором конечном отклонении энтропия может оказаться большей, чем в исходном состоянии. При таком конечном отклонении тело не вернется в исходное состояние, а наоборот, будет стремиться перейти в некоторое другое состояние равновесия, соответствующее максимуму энтропии, большему, чем максимум энтропии в первоначальном состоянии. Соответственно этой возможности среди состояний равновесия надо различать так называемые метастабильные и стабильные состояния. Если тело находится в метастабильном состоянии, то при достаточном отклонении от него тело может не вернуться в исходное состояние. Хотя метастабильное состояние в известных пределах устойчиво, но рано или поздно тело все равно перейдет из него в другое, стабильное состояние. Последнее соответствует наибольшему из всех возможных максимумов энтропии; выведенное из такого состояния тело рано или поздно вернется в него обратно.
§ 22. Принцип Ле-Шателье
Рассмотрим замкнутую систему, состоящую из среды и погруженного в нее тела. Пусть S есть полная энтропия системы, а у — некоторая величина, относящаяся к телу, причем такая, что условие максимума S по отношению к ней, т. е. dS/dy = 0, означает, что.тело само по себе находится в равновесии, не находясь при этом обязательно в равновесии со средой. Пусть, далее, х есть другая термодинамическая величина, относящаяся к тому же телу, причем такая, что если, наряду с dS/dy = 0, имеет место также и dS/dx = 0, то это означает, что тело находится не только в своем внутреннем равновесии, но также и в равновесии со средой.
Введем обозначения
* = -§-. ^=-f- (22,1)
При полном термодинамическом равновесии энтропия 5 должна быть максимальна. Для этого, кроме условий
Х=0, Г = 0, (22,2)
должны выполняться также неравенства
£)„>0' (fi>0' (22'3)
причем
(£).(£).-(£):>»■
Предположим теперь, что путем какого-либо незначительного внешнего воздействия нарушается равновесие тела со средой, причем несколько изменяется величина х и нарушается условие Х = 0; о величине же у предполагаем, что она данным воздействием непосредственно не затрагивается. Пусть Доесть изменение величины х; тогда изменение величины X в момент воздействия будет
Изменение х при постоянном у приводит, конечно, к нарушению также и условия У = 0, т. е. внутреннего равновесия тела. После того как это равновесие снова восстановится, величина X == ДХ будет иметь значение
где производная берется при постоянном, равном нулю, значении Y.
Сравним оба значения ДХ. Пользуясь свойствами якобианов, имеем
d(X,Y) fdX
(дХ \ __ д (X, Y) д (х, у) __(дХ\ \ ду
V дх)у^о~ д{х,У) ~~ д (х, Y) ~ { дх)у f dY
д (х, у) \ ду
Знаменатель второго члена в этом выражении положителен согласно условию (22,3); учитывая также неравенство (22,4), находим, что
'дХ\>(9£\ „>0, (22,5)
дх /у \ дх /у = о' ИЛИ
|(ДХХ,|>|(ДХ)у=„|. (22,6)
Неравенства (22,5) или (22,6), составляют содержание так называемого принципа Ле-Шателье.
Будем рассматривать изменение Дх величины х как меру внешнего воздействия на тело, а ДХ—как меру изменения свойств тела под влиянием этого воздействия. Неравенство (22,6) показывает, что при восстановлении внутреннего равновесия тела после внешнего воздействия, выводящего его из этого равновесия, значение ДХ уменьшается. Поэтому принцип Ле-Шателье можно сформулировать так:
Внешнее воздействие, выводящее тело из равновесия, стимулирует в нем процессы, стремящиеся ослабить результаты этого воздействия.
Поясним сказанное примерами.
Прежде всего удобно несколько видоизменить определение величин X и Y, воспользовавшись формулой (20,8), согласно которой изменение энтропии системы среда + тело равно —RmijT0, где Т0—температура среды, a Rmit]—минимальная работа, необходимая для приведения тела из состояния равновесия со средой в данное. Поэтому можно написать:
Для бесконечно малого изменения состояния тела имеем (см. (20,4))
dRmin = (T-T0)dS-(P~ P0)dV;
все величины без индекса здесь и ниже относятся к телу, а с индексом 0—к среде.
Пусть х есть энтропия тела S. Тогда X = (Т—Тл/Т0. Условие равновесия Х = 0 дает Т = Г„, т. е. равенство температур тела и среды. Неравенства (22,5) и (22,6) принимают вид
(£).>(£),..>". <22'8>
|(ДГ)„|>|(ДГ)У,.|. (22,9)
Смысл этих неравенств заключается в следующем. Изменение величины х—энтропии тела—означает, что телу сообщается (или от тела отнимается) некоторое количество тепла. В результате нарушается равновесие самого тела и, в частности, изменяется его температура (на величину (АТ)у). Восстановление равновесия в теле приводит к тому, что изменение его температуры по абсолютной величине уменьшится (станет равным (AT)Y= 0), т. е. как бы ослабляется результат воздействия, выводящего тело из равновесия. Можно сказать, что нагревание (охлаждение) тела стимулирует в нем процессы, стремящиеся понизить (повысить) его температуру.
Пусть теперь х есть объем тела V. Тогда Х = — (Р—Р0)/Т0. В равновесии Х = 0, т.е. Р = Р„. Неравенства (22,5) и (22,6)дают
(£).<(£),..«>. <22.'°>
|(ДР),|>|(4Я)у..|. (22,11)
Если тело выводится из равновесия путем изменения его объема (при неизменной температуре), то меняется, в частности, его давление; восстановление равновесия в теле приводит к уменьшению абсолютной величины изменения давления. Имея в виду,
§ 23]
ТЕОРЕМА HEPHCTA
что уменьшение объема тела увеличивает его давление (и наоборот), можно сказать, что уменьшение (увеличение) объема тела стимулирует в нем процессы, стремящиеся уменьшить (увеличить) его давление.
В дальнейшем мы встретимся с целым рядом различных применений этих результатов (к растворам, химическим реакциям и т. п.).
Отметим еще, что если в неравенствах (22,8) в качестве величины у взять объем тела, то будем иметь
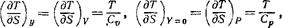
поскольку условие Y = 0 означает в этом случае Р = Р0, т. е. постоянство давления. Таким образом, мы снова получаем известные уже нам неравенства Ср > Cv > 0.
Аналогично, если в (22,10) в качестве у взять энтропию тела, то условие Y = 0 будет означать постоянство температуры Т — Т0, и мы найдем
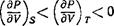
— тоже известный уже нам результат.
§ 23. Теорема Нернста
Тот факт, что теплоемкость Cv положительна, означает, что энергия есть монотонно возрастающая функция температуры. Напротив, при падении температуры энергия монотонно уменьшается, и, следовательно, при наименьшей возможной температуре, т. е. при абсолютном нуле, тело должно находиться в состоянии с наименьшей возможной энергией. Если рассматривать энергию тела как сумму энергий частей, на которые можно мысленно его разделить, то можно утверждать, что и каждая из этих частей будет находиться в состоянии с наименьшей энергией; ясно, что минимальному значению суммы должны соответствовать и минимальные значения всех ее слагаемых.
Таким образом, при абсолютном нуле любая часть тела должна находиться в одном определенном—основном — квантовом состоянии. Другими словами, статистические веса этих частей равны единице, а потому равно единице и их произведение, т. е. статистический вес макроскопического состояния тела в целом. Энтропия же тела—логарифм его статистического веса — равна, следовательно, нулю.
Поэтому мы приходим к следующему важному заключению: энтропия всякого тела обращается в нуль при абсолютном нуле
температуры (так называемая теорема Нернста (W. Nernst, 1906)г).
Подчеркнем, что эта теорема является следствием квантовой статистики, в которой существенную роль играет понятие о дискретных квантовых состояниях. Она не может быть доказана в чисто классической статистике, в которой энтропия вообще определяется лишь с точностью до произвольной аддитивной постоянной (см. § 7).
Теорема Нернста позволяет сделать заключения и о поведении некоторых других термодинамических величин при 7-»-0. Так, легко видеть, что при 7 = 0 обращаются в нуль теплоемкости — как Ср, так и Cv:
Cp = Cv = 0 при 7 = 0. (23,1)
Это следует непосредственно из определения теплоемкости, написанного в виде
Р_ rpdS___ dS
Ь~ df~dhTf-
При Т->0 имеем: lnT-s—оо, а поскольку S стремится к постоянному пределу (к нулю), ясно, что написанная производная стремится к нулю.
Далее, обращается в нуль коэффициент теплового расширения
{w)p = 0 ПРИ г=0- <23'2)
Действительно, эта производная равна производной — (dS/dP)T
(см. (16,4)), обращающейся при 7 = 0 в нуль, поскольку S = 0
при 7 = 0 и произвольном давлении.
Аналогично убеждаемся в том, что и
(§)v = 0 при 7 = 0. (23,3)
Обычно энтропия обращается при 7->0 в нуль по степенному закону, т. е. как S = aTn, где а—функция давления или объема. Очевидно, что в этом случае теплоемкости и величины (dV/dT)P, (dP/dT)v обращаются в нуль по тому же закону (с тем же п).
Наконец, можно видеть, что разность Ср—С„ обращается в нуль быстрее, чем самые теплоемкости, т. е.
| *) Во избежании недоразумений подчеркнем, что речь идет о стремлении температуры к нулю при каких-либо в остальном неизменных условиях—скажем, при постоянном объеме или постоянном давлении. Если же, например, стремить к нулю температуру газа одновременно с неорганиченным уменьшением его плотности, то энтропия может и не обратиться в нуль. |
^^ = 0 при 7 = 0. (23,4)
Действительно, пусть при Т-+0 энтропия стремится к нулю по законуS ~ Т". Из формулы (16,9) видно, чтотогда Cp—Cv ~ Т2п+1, так что (C„—Cl)/Cp^Tn+1 (следует иметь в виду, что сжимаемость (дУ/дР)т остается при Т = 0, вообще говоря, отличной от нуля конечной величиной).
Если известна теплоемкость тела во всем диапазоне изменения температуры, то энтропия может быть вычислена путем интегрирования, причем теорема Нернста позволяет установить значение постоянной интегрирования. Так, зависимость энтропии от температуры при заданном значении давления определится по формуле
7С
S = §-f-dT. (23,5)
о
Для тепловой функции аналогичная формула гласит:
т
W = W.+ \cpdT, (23,6)
о
где W0—значение тепловой функции при Г —0. Для термодинамического потенциала Ф = № — TS соответственно имеем
т т с
Q> = W0 + §CpdT—T§-fidT. (23,7)
о о
§ 24. Зависимость термодинамических величин от числа частиц
Наряду с энергией и энтропией свойством аддитивности обладают также и такие термодинамические величины, как р, Ф, W (как это следует непосредственно из их определения, если учесть, что давление и температура постоянны вдоль находящегося в равновесии тела). Это свойство позволяет сделать определенные заключения о характере зависимости всех этих величин от числа частиц в теле. Мы будем рассматривать здесь тела, состоящие из одинаковых частиц (молекул); все результаты могут быть непосредственно обобщены на тела, состоящие из различных частиц— смеси (см. § 85).
Аддитивность величины означает, что при изменении количества вещества (а с ним и числа частиц N) в некоторое число раз эта величина меняется во столько же раз. Другими словами, можно сказать, что аддитивная термодинамическая величина должна быть однородной функцией первого порядка относительно аддитивных переменных.
Выразим энергию тела в виде функции энтропии и объема, а также числа частиц. Поскольку 5 и V сами по себе тоже аддитивны, эта функция должна иметь вид
E = Nf{lT>ir)' (24,1)
что является наиболее общим видом однородной функции первого порядка en N, S и V. Свободная энергия F есть функция от N, Т и V. Поскольку температура постоянна вдоль тела, а объем аддитивен, то из тех же соображений можно написать
(24,2)
Совершенно аналогично для тепловой функции W, выраженной в виде функции от N, S и давления Р, получим
W = Nf(±,p). (24,3)
Наконец, для термодинамического потенциала как функции от N, Р, Т имеем
Ф — Nf(P, Т). (24,4)
В предыдущем изложении мы по существу рассматривали число частиц как параметр, имеющий для каждого тела заданное постоянное значение. Будем теперь формально рассматривать N как еще одну независимую переменную. Тогда в выражения дифференциалов термодинамических потенциалов должны быть добавлены члены, пропорциональные dN. Например, для полного дифференциала энергии будем писать:
dE=*TdS- PdV+^dN, (24,5)
где посредством ц мы обозначили частную производную
Величина ц называется химическим потенциалом тела. Анало-
гично имеем теперь
dW = TdS + VdP + iLdN, (24,7)
dF = — SdT—PdV + pdN, (24,8)
d<b = — SdT-\-VdP+[idN (24,9)
с тем же \i. Из этих формул следует, что
-(»),.,-(£),.,-(»),.,• <2^>
т. е. химический потенциал можно получить дифференцированием любой из величин Е, W, F, Ф по числу частиц, однако при этом он окажется выраженным через различные переменные.
Дифференцируя Ф, написанное в виде (24,4), найдем, что и^дФ/dN = f(P, Т), т. е.
Ф = ЛГц. (24,11)
Таким образом, химический потенциал тела (состоящего из одинаковых частиц) есть не что иное, как его термодинамический потенциал, отнесенный к одной молекуле. Будучи выражен в функции от Р и Г, химический потенциал не зависит от N. Для дифференциала химического потенциала можно, следовательно, сразу написать следующее выражение:
dp = — sdT + vdP, (24,12)
где s и v—энтропия и объем, отнесенные к одной молекуле.
Если рассматривать (как мы до сих пор обычно делали) определенное количество вещества, то число частиц в нем есть заданная постоянная величина, а его объем—величина переменная. Выделим теперь внутри тела некоторый определенный объем и будем рассматривать то вещество, которое заключено в этом объеме; при этом переменной величиной будет число частиц N, а объем V будет постоянным. Тогда, например, равенство (24,8) сведется к
dF = — SdT + iidN. Здесь независимыми переменными являются Т и N; введем такой термодинамический потенциал, для которого второй независимой переменной было бы не N, а ц. Для этого подставляем yidN^ = d(pJV)—JVdp, и получаем
d (F—tiN) = — SdT—N dp.
Ho [iN = Ф, a F—Ф = — PV. Таким образом, новый термодинамический потенциал (который мы обозначим буквой fl) равен просто
Q = — PV, (24,13)
причем
dQ = — SdT — NdyL. (24,14)
Число частиц получается дифференцированием Q по химическому потенциалу при постоянных температуре и объеме:
"--[*)т.,-У{*)т.Г <24'15>
Подобно тому, как было доказано равенство между собой небольших изменений Е, W, F и Ф (при постоянных соответствующих парах величин) легко показать, что изменение (6Q)r, д, v при постоянных Т, p., V обладает тем же свойством. Иными словами,
фЕ)з, v,n = (Щт, v,n = (6Ф)г, р, n = (6W)S, p,n = (Щт, v, ц. (24,16)
Эти равенства уточняют и расширяют теорему о малых добавках (15,12).
Наконец, аналогично тому, как это было сделано в §§ 15 и 20 для свободной энергии и термодинамического потенциала, можно показать, что работа при обратимом процессе, происходящем при постоянных Т, V и р, равна изменению потенциала Q. В состоянии же теплового равновесия потенциал Q имеет минимальное значение по отношению ко всякому изменению состояния при постоянных Т, V, \1.
Задач а
Получить выражение для теплоемкости Cv в переменных Т, ц., V. Ре шеи и е. Преобразуем производную CV=T 0S/dT)v, n к переменным Т, V, fi, для чего пишем (рассматривая V все время как постоянную):
д (S, N) /dS\ fdN\
'д1Л =d(s,N)_ d(T,li) fds\ узц МагЛ*
кдТ]\ д (Т, N) д (Т, N) -\дТ]ц fdN_\
д(Т,р) [дц)т
„ fdS \ d2Q (dN \
Но Wh^-Wdrv&rti поэтому
{дт)„ (dN_\
\дц Jt)
§ 25. Равновесие тела во внешнем поле
Рассмотрим тело, находящееся в постоянном (во времени) внешнем поле. Различные части тела находятся при этом в различных условиях, поэтому тело будет неоднородным. Одним из условий равновесия такого тела является по-прежнему постоянство температуры вдоль тела; давление же будет теперь различно в различных его точках.
Для вывода второго условия равновесия выделим из тела два определенных соприкасающихся объема и потребуем максимальности их энтропии S = S1 + Sg при неизменном состоянии остальных частей тела. Одно из необходимых условий максимума заключается в равенстве нулю производной dS/dN^ Поскольку общее число частиц Л^ + #2 в двух данных частях тела рассматривается как постоянное, имеем
dS _ dSt dS2 dN2 _ dSt _ dS2 _ fl
Но из равенства dE==TdS-\~ndN, написанного в виде
dS = ~—^dN,
мы видим, что производная -Ц, (при постоянных ЕиТ) равна — и./7\
Таким образом, имеем: ii1/T1 = n!s/Ta. Но при равновесии Tt — Ttt так что и р,1 = (А2. Мы приходим, следовательно, к результату, что при равновесии во внешнем поле, кроме постоянства температуры должно соблюдаться условие
ц = const, (25,1)
т. е. химические потенциалы всех частей тела должны быть равны друг другу. При этом химический потенциал каждой части есть функция ее температуры и давления, а также параметров, определяющих внешнее поле. Если поле отсутствует, то из постоянства (I и Г автоматически следует и постоянство давления.
В поле тяготения потенциальная энергия молекулы и есть функция только координат х, у, z ее центра тяжести (и не зависит от расположения атомов внутри молекулы). В этом случае изменение термодинамических величин тела сводится к добавлению к его энергии потенциальной энергии молекул в поле. В частности, химический потенциал (термодинамический потенциал, отнесенный к одной молекуле) примет вид р. = (А0 -\-и(х, у, z), где fi0 (Р, Т) есть химический потенциал в отсутствие поля. Таким образом, условие равновесия в поле тяготения можно написать в виде
ц0 (Р, Т) + и (х, у, z) = const. (25,2)
В частности, в однородном поле тяжести u — tngz (m — масса молекулы, g— ускорение силы тяжести, z — вертикальная координата). Дифференцируя равенство (25,2) по координате z при постоянной температуре, получим
vdP = —mgdz,
где v = (dnJdP)T — удельный объем. При небольших изменениях давления v можно считать постоянным. Вводя плотность p = m/v и интегрируя, получим
Р — const—pgz,
т. е. обычную формулу для гидростатического давления в несжимаемой жидкости.
§ 26. Вращающиеся тела
В состоянии теплового равновесия возможно, как мы видели в § 10, лишь равномерное поступательное движение и равномерное вращение тела как целого. Равномерное поступательное движение никакого особого рассмотрения не требует, так как согласно принципу относительности Галилея оно никак не сказывается на механических, а потому и термодинамических свойствах тела, и его термодинамические величины меняются лишь в том смысле, что к энергии добавляется кинетическая энергия тела.
Рассмотрим тело, равномерно вращающееся вокруг неподвижной оси с угловой скоростью Q. Пусть Е(р, q) есть энергия тела в неподвижной системе координат, a E'(p,q)—энергия в системе координат, вращающейся вместе с телом. Как известно из механики, эти величины связаны друг с другом соотношением
E'{p,q) = E(p,q)-im.(p,q), (26,1)
где М(р, q)—момент импульса тела1).
Таким образом, энергия Е' (р, q) зависит, как от параметра, от угловой скорости Q, причем
Усредняя это равенство по статистическому распределению и воспользовавшись формулой (11,3), получим
дЕ' Л =—М, (26,2)
да s
где Е' — Е'(р, q), М = М(р, q)—средние (термодинамические) энергия и момент импульса тела.
На основании этого соотношения мы можем написать дифференциал энергии вращающегося тела при заданном объеме в виде
dE'= Т dS — f\du. (26,3)
Для свободной энергии F' = E'—TS (во вращающейся системе координат) соответственно имеем
dF' = —5 dT — mdQ. (26,4)
Усредняя равенство (26,1), получим
£' = £—МЙ. (26,5)
Дифференцируя это равенство и подставляя (26,3), получим дифференциал энергии в неподвижной системе координат
dE = TdS + Qdtl. (26,6)
Для свободной энергии F = E—TS соответственно имеем
dF=—SdT+Qdm. (26,7)
Таким образом, в этих соотношениях независимой переменной
х) См. I, § 39. Хотя произведенный там вывод формулы (39,13) основан на классической механике, но в квантовой теории в точности те же соотношения справедливы для операторов соответствующих величин. Поэтому все выводимые ниже термодинамические соотношения не зависят от того, какой механикой описывается движение частиц тела.

 (26,8)
(26,8)
Как известно из механики, равномерное вращение в известном смысле эквивалентно появлению двух силовых полей: поля центробежных сил и поля кориолисовых сил. Центробежные силы пропорциональны размерам тела (они содержат расстояние до оси вращения); силы же Кориолиса от размеров тела не зависят вовсе. Благодаря этому обстоятельству влияние последних на термодинамические свойства вращающегося макроскопического тела совершенно ничтожно по сравнению с влиянием первых, и ими обычно можно полностью пренебречь1). Поэтому условие теплового равновесия вращающегося тела получится просто подстановкой в (25,2) в качестве и (х, у, г) центробежной энергии частиц:
MP, T)-^^ = const, (26,9)
где Ро—химический потенциал покоящегося тела, т—масса молекулы, г — расстояние до оси вращения. По той же причине полную энергию вращающегося тела Е можно написать в виде суммы его внутренней энергии (которую мы обозначим здесь посредством Ет) и кинетической энергии вращения:
Е = ЕВК + ^, (26,10)
где /—момент инерции тела относительно оси вращения. Надо иметь в виду, что вращение, вообще говоря, меняет распределение масс в теле, поэтому момент инерции и внутренняя энергия тела сами, вообще говоря, зависят от Q (или от М). Лишь при достаточно медленном вращении эти величины можно считать постоянными, не зависящими от Q.
Рассмотрим изолированное равномерно вращающееся твердое тело с заданным распределением масс в нем. Поскольку энтропия тела есть функция его внутренней энергии, то в данном случае
s-s[b-$).
| *) Можно показать, что в классической статистике кориолисовы силы вообще не влияют на статистические свойства тела—см. § 34. |
Вследствие замкнутости тела его полная энергия и момент вращения сохраняются, а энтропия должна иметь максимальное значение, возможное при данных М и Е. Поэтому мы приходим к выводу, что равновесное вращение тела происходит вокруг оси, относительно которой момент инерции имеет наибольшее возможное значение. Тем самым автоматически подразумевается, что ось вращения во всяком случае является осью инерции тела. Последнее обстоятельство, впрочем, заранее очевидно: если тело вращается вокруг оси, не являющейся осью инерции, то, как известно из механики, ось вращения сама будет смещаться (прецессиро-вать) в пространстве, т. е. вращение будет неравномерным, а потому и неравновесным.
§ 27. Термодинамические соотношения в релятивистской области
Релятивистская механика приводит к ряду изменений в обычных термодинамических соотношениях. Мы рассмотрим здесь те из этих изменений, которые представляют наибольший интерес.
Если микроскопическое движение частиц, составляющих тело, становится релятивистским, то общие термодинамические соотношения не изменяются, но возникает важное неравенство между давлением и энергией тела
р<4г- (ад
где Е—энергия тела, включающая в себя энергию покоя входящих в его состав частиц1).
Принципиальный интерес представляют изменения, вносимые общей теорией относительности в условиях теплового равновесия при учете создаваемого самим телом гравитационного поля. Рассмотрим неподвижное макроскопическое тело; его гравитационное поле будет, разумеется, постоянным. В постоянном гравитационном поле надо отличать сохраняющуюся энергию Е0 какой-либо малой части тела от энергии Е, измеренной наблюдателем, находящимся в данном месте; эти две величины связаны друг с другом соотношением
Ea = EVg^,
| х) См. II, § 35. Напомним, однако, что общего доказательства этого неравенства, пригодного для всех существующих в природе (не только электромагнитных) типов взаимодействия между частицами, в настоящее время не существует. |
где g00—временная компонента метрического тензора (см. II, §88; формула (88,9) с у = 0, тс2 = Е). Но по самому смыслу приведенного в § 9 доказательства постоянства температуры вдоль находящегося в равновесии тела ясно, что должна быть постоянна величина, получающаяся дифференцированием энтропии по сохраняющейся энергии Е0. Температура же Т, измерепная наблюдателем, находящимся в данной точке пространства, получается дифференцированием энтропии по энергии Е и, следовательно, будет различна в разных точках тела.
Для вывода количественного соотношения замечаем, что энтропия по существу своего определения зависит исключительно от внутреннего состояния тела и потому не изменяется при появлении гравитационного поля (в той мере, в которой это поле не влияет на внутренние свойства тела, —условие, которое фактически всегда выполнено). Поэтому производная по энтропии от сохраняющейся энергии Е„ будет равна T\f gm и, таким образом, одно из условий теплового равновесия требует постоянства вдоль тела величины
TVlfa = const. (27,2)
Аналогичным образом видоизменяется второе условие равновесия— постоянство химического потенциала. Химический потенциал определяется как производная от энергии по числу частиц. Поскольку число частиц, разумеется, гравитационным полем не меняется, то для химического потенциала, измеренного в каждой данной точке, получаем такое же соотношение, как и для температуры:
pKi^ = const. (27,3)
Заметим, что соотношения (27,2—3) можно написать в виде
T = const~, ii = consb-^, (27,4)
позволяющем рассматривать тело не только в той системе отсчета, в которой оно неподвижно, но и в таких, в которых оно движется (вращается как целое). При этом производная dx°/ds должна браться по мировой линии, описываемой данной точкой тела.
В слабом (ньютоновском) гравитационном поле g00 = 1 -f-2cp/c2, где ср — гравитационный потенциал (см. II, § 87). Подставляя это выражение в (27,2) и извлекая корень, найдем в том же приближении
Г = const- (l—J). (27,5)
Имея в виду, что ср < 0, находим, что при равновесии температура выше в тех местах тела, в которых | ср | больше, т. е. в глубине тела. При предельном переходе к нерелятивистской механике (с—► оо) (27,5) переходит, как и следовало, в Т = const.
Аналогичным образом можно преобразовать условие (27,3), причем надо иметь в виду, что релятивистский химический потенциал при предельном переходе к классической механике переходит не непосредственно в обычное (нерелятивистское) выражение для химического потенциала в отсутствие поля, которое мы обозначим здесь посредством р,0, а в p0-f-mc2, где ж2—энергия покоя
отдельной частицы тела. Поэтому имеем
И Vffa ~ О*, +mc2) (l wц, + mc% + m<p,
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 434; Нарушение авторских прав?; Мы поможем в написании вашей работы!