
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ol — V2X 5 страница
|
|
|
|
2 2 aw= <&т 2 (е^/т 2 е-Епм'Л = 1.
n п
Отсюда получаем для термодинамического потенциала Q следующее выражение:
а = -Г1п2[е^/г2е-£«л^1. (35,3)
| г) Это распределение иногда называют большим каноническим. |
n

§ 36. Вывод термодинамических соотношений из распределения Гиббса
Распределение Гиббса играет основную роль во всей статистике, поэтому изложим здесь еще один способ его обоснования. Это распределение было по существу выведено нами еще в §§ 4 и 6 непосредственно из теоремы Лиувилля. Мы видели, что применение теоремы Лиувилля (вместе с соображениями о мультипликативности функций распределения подсистем) позволяет сделать заключение о том, что логарифм функции распределения подсистемы должен быть линейной функцией ее энергии:
In wn = а + 6ZT,
(36,1)
причем коэффициенты В одинаковы для всех подсистем данной замкнутой системы (см. (6,4), а в классическом случае—аналогичное соотношение (4,5)). Отсюда
ш„ = ехр(а + В£„);
если ввести формальным образом обозначения 6 = —1/Г, a —FIT, то это выражение совпадает по форме с распределением Гиббса (31,1). Остается показать, что из самого распределения Гиббса, т. е. чисто статистическим образом, можно вывести основные термодинамические соотношения.
Мы уже видели, что величина В, а потому и Т, должна быть одинаковой для всех частей находящейся в равновесии системы. Далее, очевидно, что должно быть В < 0, т. е. Т > 0; в противном случае нормировочная сумма Iwn неизбежно разойдется (поскольку благодаря наличию кинетической энергии частиц энергия Еп может принимать сколь угодно большие значения). Все эти свойства совпадают с основными свойствами термодинамической температуры.
Для вывода же количественного соотношения исходим из условия нормировки
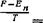
п
 |
Продифференцируем это равенство, рассматривая его левую сторону как функцию Т и некоторых величин Xlt %2, характеризующих внешние условия, в которых находится рассматриваемое тело; эти величины могут, например, определять форму и размеры занимаемого телом объема. Уровни энергии Еп зависят от значений Xlt Хг,... как от параметров. Производя дифференцирование, пишем:
(для краткости рассматриваем здесь всего один внешний параметр к). Отсюда
п п \ п J
В левой стороне равенства 2^=1, а в пРав°й
п п
| (36,2) |
Учитывая также, что F—£ = — TS и что1)
дк ~~ дк '
получаем окончательно
dF = — SdT + ^-dK.
Это и есть общий вид дифференциала свободной энергии.
Таким же образом может быть получено и распределение Гиббса с переменным числом частиц. Если рассматривать число частиц как динамическую переменную, то ясно, что оно тоже будет (для замкнутой системы) «интегралом движения» и к тому же аддитивным. Поэтому надо будет писать:
lnwnN = a + p'En + yN, (36,3)
где у, как и В, должно быть одинаковым для всех частей равновесной системы. Положив
ОС — у, р — -jT, У ~ f '
получим распределение вида (35,2), после чего тем же способом, как и выше, можно получить выражение для дифференциала потенциала й.
1) Если гамильтониан Я (а с ним и его собственные значения Еп) зависит от некоторого параметра к, то
дк V дк)пп
(см. III, (11,16)), откуда после статистического усреднения получается формула (36,2).
ГЛАВА IV
ИДЕАЛЬНЫЙ ГАЗ
§ 37. Распределение Больцмана
Одним из важнейших объектов изучения статистической физики является так называемый идеальный газ. Под этим названием подразумевают газ, взаимодействие между частицами (молекулами) которого настолько слабо, что им можно пренебречь. Физически допустимость такого пренебрежения может быть обеспечена либо малостью взаимодействия частиц при любых расстояниях между ними, либо достаточной разреженностью газа. В последнем, наиболее важном случае разреженность газа приводит к тому, что его молекулы почти всегда находятся на значительных расстояниях друг от друга, на которых силы взаимодействия уже достаточно малы.
Отсутствие взаимодействия между молекулами позволяет свести квантовомеханическую задачу об определении уровней энергии Еп всего газа в целом к задаче об определении уровней энергии отдельной молекулы. Эти уровни мы будем обозначать посредством еА, где индекс k представляет собой совокупность квантовых чисел, определяющих состояние молекулы. Энергии Еп выразятся тогда в виде сумм энергий каждой из молекул.
Надо, однако, иметь в виду, что даже при отсутствии непосредственного силового взаимодействия в квантовой механике имеет место своеобразное взаимное влияние частиц, находящихся в одинаковом квантовом состоянии (так называемые обменные эффекты). Так, если частицы подчиняются статистике Ферми, то это влияние проявляется в том, что в каждом квантовом состоянии может находиться одновременно не более одной частицы1); аналогичное влияние, проявляющееся иным образом, имеет место и для частиц, подчиняющихся статистике Бозе.
Обозначим посредством пк число частиц в газе, находящихся в k-м квантовом состоянии; числа пк называют числами заполне-
!) Подчеркнем, что, говоря о квантовом состоянии отдельной частицы, мы всегда будем иметь в виду состояния, полностью определенные набором значений всех квантовых чисел (в том числе направлением момента частицы, если она обладает таковым). Их не следует смешивать с квантовыми уровнями энергии—одному и тому же уровню энергии может соответствовать ряд различных квантовых состояний (если уровень вырожден).
ния различных квантовых состояний. Поставим задачу о вычислении средних значений nk этих чисел, причем обратимся к подробному изучению чрезвычайно важного случая, когда все числа
nh<l. (37,1)
Физически этот случай соответствует достаточно разреженному газу. В дальнейшем будет установлен критерий, обеспечивающий выполнение этого условия, но уже сейчас укажем, что фактически оно выполняется для всех обычных молекулярных или атомных газов. Это условие нарушилось бы лишь при таких больших плотностях, при которых вещество фактически уже ни в какой мере нельзя было бы рассматривать как идеальный газ.
Условие nk<^.\ для средних чисел заполнения означает, что в каждый момент времени в каждом квантовом состоянии фактически находится не более одной частицы. В связи с этим можно пренебрегать не только непосредственным силовым взаимодействием частиц, но и их косвенным квантовомеханическим взаимным влиянием, упомянутым выше. Это обстоятельство в свою очередь позволяет применить к отдельным молекулам формулу распределения Гиббса.
Действительно, распределение Гиббса было выведено нами для тел, являющихся относительно малыми, но в то же время макроскопическими частями каких-либо больших замкнутых систем. Макроскопичность тел давала возможность считать их квазизамкнутыми, т. е. в известном смысле пренебречь их взаимодействием с другими частями системы. В рассматриваемом случае квазизамкнутыми являются отдельные молекулы газа, хотя они отнюдь не представляют собой макроскопических тел.
Применив к молекулам газа формулу распределения Гиббса, мы можем утверждать, что вероятность молекуле находиться в k-м состоянии, а потому и среднее число nk молекул в этом состоянии, пропорциональны ехр(—ek/T):
nk = ae-sk/\ (37,2)
где а—постоянная, определяющаяся условием нормировки
2"*=^ (37,3)
(N — полное число частиц в газе). Распределение молекул идеального газа по различным состояниям, определяемое формулой (37,2), называется распределением Больцмана (оно было открыто Больцманом для классической статистики в 1877 г.).
Постоянный коэффициент в (37,2) может быть выражен через термодинамические величины газа. Для этого дадим еще один вывод этой формулы, основанный на применении распределения
Гиббса к совокупности всех частиц газа, находящихся в данном квантовом состоянии. Мы имеем право сделать это (даже если числа пк не малы), поскольку непосредственного силового взаимодействия между этими и остальными частицами (как и между всеми вообще частицами идеального газа) нет, а квантовомеха-нические обменные эффекты имеют место лишь для частиц, находящихся в одном и том же состоянии. Полагая в общей формуле распределения Гиббса с переменным числом частиц (35,2) Е = плгк, N = nk и приписывая индекс k величине Q, получим распределение вероятностей различных значений пк в виде
вд^ехр [°» + ^—(37)4)
В частности, да0 = ехр (QA/T) есть вероятность полного отсутствия частиц в данном состоянии. В интересующем нас здесь случае,
когда пк<^\, вероятность w0 близка к единице; поэтому в выражении а»! для вероятности наличия одной частицы в k-м состоянии можно положить, опуская члены высшего порядка малости, exp(Qft/7,)=l. Тогда
wt = e т.
Что же касается вероятностей значений «ft>l, то они в том же приближении должны быть положены равными нулю. Поэтому
nk = '£wn.nk = w1-l,
"ft
и мы получаем распределение Больцмана в виде
nA = expteS*). (37,5)
Таким образом, коэффициент в формуле (37,2) оказывается выраженным через химический потенциал газа.
§ 38. Распределение Больцмана в классической статистике
Если бы движение молекул газа (и атомов в них) подчинялось классической механике, мы могли бы ввести вместо распределения по квантовым состояниям распределение молекул по фазовому пространству, т. е. по импульсам и координатам. Пусть dN — среднее число молекул, «заключенных» в элементе объема фазового пространства молекулы dpdq = dpx... dprdqx... dqr {г — число степеней свободы молекулы). Напишем его в виде
dN = n(p, q) dx, dx = (38,1)
и будем называть п (р, q) плотностью в фазовом пространстве (хотя dx отличается множителем (2п%)~г от элемента объема фазового пространства). Мы получим теперь вместо (37,5)
ехр (38-2)
где г(р, q)—энергия молекулы как функция координат и импульсов ее атомов.
Обычно, однако, квазиклассичным оказывается не все движение молекулы, а лишь движение, соответствующее части ее степеней свободы. В частности, в газе, не находящемся во внешнем поле, всегда квазиклассично поступательное движение молекул. При этом кинетическая энергия поступательного движения входит в энергию гк молекулы как независимое слагаемое, а остальная часть энергии вовсе не содержит координат х, у, г и импульсов Рх> Ру< Рг центра инерции молекулы. Это обстоятельство позволяет выделить из общей формулы распределения Больцмана множитель, определяющий распределение молекул газа по указанным переменным. Распределение молекул по занимаемому газом объему будет, очевидно, просто однородным, а для числа молекул, приходящихся на единицу объема и имеющих импульсы (поступательного движения) в заданных интервалах dpx, dpy, dpz, получим формулу распределения Максвелла
N
V(2nmT)3/2'
Px + Py + Pz 2тТ
dpxdpydpz, (38,3)
N f m у'2
m(vx+vy+vD 2Т
dvxdvydvz (38,4)
(m—масса молекулы), нормированную на N/V частиц в единице объема.
Рассмотрим далее газ, находящийся во внешнем поле, в котором потенциальная энергия молекулы есть функция только от координат ее центра инерции: u = u(x, у, г) (таково, например, гравитационное поле). Если, как это практически всегда имеет место, поступательное движение в этом поле квазиклассично, то и (х, у, г) входит в энергию молекулы в качестве независимого слагаемого. Максвелловское распределение по скоростям молекул остается, разумеется, неизменным, а распределение но координатам центра инерции определится формулой
dNt = nue-^x-v'*vt dV. (38,5)
Эта формула дает число молекул в элементе пространственного объема dV — dxdydz; величина же
п(г) = п0е-и<х'У-гУт (38,6)
представляет собой плотность числа частиц. Постоянная п0 есть плотность в точках, где ы = 0. Формула (38,6) называется формулой Больцмана.
В частности, в однородном поле тяжести, направленном вдоль оси z, u = mgz, и распределение плотности газа определяется так называемой барометрической формулой
n(z) = n0e-m^T, (38,7)
где п0—плотность на уровне z = 0.
На больших расстояниях от Земли ее гравитационное поле должно описываться точным ньютоновским выражением, причем потенциальная энергия и обращается на бесконечности в нуль. Согласно формуле (38,6) плотность газа должна была бы иметь при этом на бесконечности отличное от нуля конечное значение. Однако конечное количество газа не может быть распределено по бесконечному объему с нигде не исчезающей плотностью. Это значит, что в гравитационном поле газ (атмосфера) не может находиться в равновесии и должен непрерывно рассеиваться в пространство.
Задачи
1. Найти плотность газа в цилиндре с радиусом R и длиной /, вращающемся вокруг оси с угловой скоростью Q (всего в цилиндре N молекул).
Решение. В §34 было указано, что вращение тела как целого эквивалентно внешнему полю с потенциальной энергией — 1/2tnQ2r'i (г — расстояние до оси вращения). Поэтому плотность газа есть
n(r) = AemQ2r*/2T.
Нормировка дает
NmQ4na'rt'2T
п (/■)=■
2ягг(^й2Л2/27-О'
2. Найти распределение частиц по импульсам для релятивистского идеального газа.
Решение. Энергия релятивистской частицы выражается через ее импульс
посредством е = с ]//?г2с2 + р2 (с—скорость света). Нормированное распределе-
ние по импульсам есть ________
/ • с Vm2c2 + P2 N
N_ 6Хр \ _______ Т)dpxdpvdpz
d V п (Т \2 /тс2\. Т v /тс2\ 4л (пк)3 '
где К0, Ki—функции Макдональда (функции Ганкеля от мнимого аргумента). При вычислении нормировочного интеграла использованы формулы:
V
о
К[ (z) = -±-K1 (z)-K0 (2).
§ 39. Столкновения молекул
Молекулы газа, заключенного в сосуде, сталкиваются при своем движении с его стенками. Вычислим среднее число ударов молекул газа об единицу поверхности стенки за единицу времени.
Выберем какой-нибудь элемент поверхности стенки сосуда и введем систему координат с осью г, направленной перпендикулярно к этому элементу поверхности (который можно теперь написать в виде dxdy). Из молекул газа в единицу времени долетят до стенки сосуда, т. е. столкнутся с ней, только те, координаты z которых не больше, чем компонента vz их скорости по этой оси (которая, конечно, должна к тому же быть направлена к стенке, а не в противоположную сторону).
Число dvv столкновений молекул в единицу времени (отнесенное к единице площади поверхности стенки), при которых компоненты скорости лежат в заданных интервалах dvx, dvy, dvz, получится, следовательно, умножением распределения (38,4) на объем цилиндра с основанием 1 см2 и высотой, равной vz. Мы получим тогда
dvv = T(,2nrJ е z'vzdvxdvydvz. (39,1)
Отсюда легко найти полное число v ударов молекул газа об единицу поверхности стенки сосуда в единицу времени. Для этого проинтегрируем (39,1) по всем скоростям vz от 0 до оо и по vx и vv от —оо до +°° (по vz не надо интегрировать от —оо до О, так как при vz < 0 молекула летит в сторону, противоположную стенке, и, следовательно, не столкнется с ней). Это дает
*=тУш = уЬ? (39'2)
(плотность газа выражена через его давление согласно уравнению Клапейрона).
Формулу (39,1) можно написать в сферических координатах в пространстве скоростей, вводя вместо vx, vy, vz абсолютную величину скорости v и полярные углы 0 и ср, определяющие ее направление. Если выбрать полярную ось по оси г, то vz = v cos б и
dvv = -^- 3/2 ехр ^— Tffrj v3 sin 9 cos 6 dQ dy dv. (39,3)
Рассмотрим теперь столкновения молекул газа друг с другом. Для этого необходимо найти предварительно распределение молекул по их скоростям (скорость есть везде скорость центра инерции) относительно друг друга. При этом мы выбираем какую-нибудь из молекул газа и рассматриваем движение всех остальных молекул относительно этой, т. е. для каждой молекулы ■ мы


(39,5)
Полное число таких столкновений, происходящих в единицу времени во всем объеме газа, равно, очевидно, v'N/2.

Задачи

§ 40. Неравновесный идеальный газ
Распределение Больцмана может быть выведено еще и совсем иным способом, непосредственно из условия максимальности энтропии газа в целом, рассматриваемого как замкнутая система. Этот вывод представляет существенный самостоятельный интерес, поскольку он основан на методе, дающем возможность вычислить энтропию газа, находящегося в произвольном неравновесном макроскопическом состоянии.
Всякое макроскопическое состояние идеального газа можно характеризовать следующим образом. Распределим все квантовые состояния отдельной частицы газа по группам, каждая из которых содержит близкие состояния (обладающие, в частности, близкими энергиями), причем как число состояний в каждой группе, так и число находящихся в них частиц все же очень велики. Перенумеруем эти группы состояний номерами / = 1,2, и пусть Gj есть число состояний в /-й группе, a Nj—число частиц в этих состояниях. Тогда набор чисел N j будет полностью характеризовать макроскопическое состояние газа.
Задача о вычислении энтропии газа сводится к задаче об определении статистического веса АГ данного макроскопического состояния, т. е. числа микроскопических способов, которыми это состояние может быть осуществлено. Рассматривая каждую группу из N j частиц как независимую систему и обозначая посредством АГ; ее статистический вес, можем написать:
АГ = Д АГ,,
(40,1)
Таким образом, задача сводится к вычислению ДГ,-.
В статистике Больцмана средние числа заполнения всех квантовых состояний малы по сравнению с единицей. Это значит, что числа Nj частиц должны быть малы по сравнению с числами Gj состояний (Nj<^.Gj), но, конечно, сами по себе все же очень велики. Как было объяснено в § 37, малость средних чисел заполнения позволяет считать, что все частицы распределяются по различным состояниям совершенно независимо друг от друга. Помещая каждую из N j частиц в одно из Gf состояний, получим всего G^j возможных распределений, среди которых, однако, есть тождественные, отличающиеся лишь перестановкой частиц (частицы все одинаковы). Число перестановок Nt частиц есть Nf\, и таким образом, статистический вес распределения Nj частиц по Gj состояниям равен
М\ = ОрЩ/.. (40,2)
Энтропия газа вычисляется как логарифм статистического веса S = ln АГ = 2Ьт ДГ,. Подставив (40,2), имеем
S = S(W/lnGy—lniV,.!).
i
Имея в виду, что числа N j велики, воспользуемся для InA^I приближенной формулойх)
lniV! ttN\n(N/e) (40,3)
и получим
S = E^ln|f- (40,4)
Эта формула решает поставленную задачу, определяя энтропию идеального газа, находящегося в произвольном макроскопическом состоянии, определяющемся набором чисел Nj. Перепишем ее, введя средние числа и,- частиц в каждом из квантовых состояний /-й группы: tij = Nj/Gj. Тогда
5=HGAln-=-- (40>5)
Если движение частиц квазиклассично, то в этой формуле можно перейти к распределению частиц по фазовому простран-
1) При большом Л? можно приближенно заменить сумму lnJV!=lnl-f-
n
+ In 2+... -f-ln N интегралом ^ Inx-dx, откуда и получается (40,3).
о
ству. Разделим фазовое пространство частицы на участки ApV> Aq{J'\ каждый из которых мал, но содержит все же большое число частиц. Числа квантовых состояний, приходящихся на эти участки, равны
G a£W! = AtV> (4о)6)
J {2л%У
(г—число степеней свободы частицы), а числа частиц в этих состояниях напишем в виде Nj = n(p, q)Ax{J\ где п(р, q) — плотность распределения частиц в фазовом пространстве. Подставляем эти выражения в (40,5), после чего, имея в виду, что участки Дт(/' малы, а их число велико, заменяем суммирование по / интегрированием по всему фазовому пространству частицы:
S = Jnln-^dr. (40,7)
В состоянии равновесия энтропия должна иметь максимальное значение (в применении к идеальному газу это утверждение иногда называют Н-теоремой Больцмана). Покажем, каким образом из этого требования можно найти функцию распределения частиц газа в состоянии статистического равновесия. Задача заключается в нахождении таких tij, при которых сумма (40,5) имеет максимальное значение, возможное при дополнительных условиях
2 bNi=2 ^fijUj=е,
i i
выражающих постоянство полного числа частиц N и полной энергии Е газа. Следуя известному методу неопределенных множителей Лагранжа, надо приравнять нулю производные
JL(S + aN+№ = 0. (40,8)
Orlj
где а, р — некоторые постоянные. Произведя дифференцирование,
найдем
Gj (— In п/ + а + 8еу) = 0, откуда 1пга, = а + 6еу, или
tij = ехр (а + Веу).
Это — не что иное, как известное уже нам распределение Больцмана, причем постоянные а и р* связаны с Т и ц посредством а = ц/7\ р = -1/7-1).
§ 41. Свободная энергия больцмановского идеального газа
Применим общую формулу (31,3)
F = — Т\п^е~Еп1т (41,1)
п
для вычисления свободной энергии идеального газа, подчиняющегося статистике Больцмана.
Написав энергию Е„ в виде суммы энергий гк, мы можем свести суммирование по всем состояниям газа к суммированию по всем состояниям отдельной молекулы. Каждое состояние газа будет определяться набором N (N—число молекул в газе) значений ек, которые в больцмановском случае можно считать все различными между собой (в каждом молекулярном состоянии—не более одной молекулы). Написав е~Е"1т в виде произведения множителей е_Е*/г'для каждой из молекул и суммируя независимо по всем состояниям каждой молекулы, мы получили бы выражение
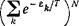
Набор возможных значений ek для всех молекул газа одинаков, а потому одинаковы и суммы 2ехР(—4lT)-
Необходимо, однако, иметь в виду следующее обстоятельство. Все наборы N различных значений гк, отличающиеся лишь распределением одинаковых молекул газа по уровням ek, соответствуют одному и тому же квантовому состоянию газа. В статистической же сумме в формуле (41,1) каждое из состояний должно учитываться лишь один раз2). Поэтому мы должны еще разделить выражение (41,2) на число возможных перестановок N молекул друг с другом, т. е. на N1 3).
Таким образом,
Ze-W-kteeSY. (41,3)
| х) Эти значения а и |5 можно было предвидеть заранее: уравнения (40,8) могут быть записаны в виде соотношения между дифференциалами dS + adN + fidE^O, которое должно совпадать с выражением дифференциала внутренней энергии (при заданном объеме) dE = Т dS-\~ndN. 2) Ср. примечание на стр. 110. 8) Существенно, что в статистике Больцмана роль членов, содержащих одинаковые е*, в выражении (41,2) относительно мала. |
п \ k J
Подставляя это выражение в (41,1), получаем
F = — TN 1п2е"8*/Г + ^1пЛП
k
Поскольку N—очень большое число, то для 1пЛП можно воспользоваться формулой (40,3). В результате получим следующую формулу:
F = -NT\n\^^e-*blT, (41,4)
которая позволяет вычислить свободную энергию любого газа, состоящего из одинаковых частиц и подчиняющегося статистике Больцмана.
В классической статистике формула (41,4) должна быть написана в виде
F = — NT\vijj j<re<P- Mux, (41,5)
где интегрирование производится по фазовому пространству молекулы, a dx определено в (38,1).
§ 42. Уравнение состояния идеального газа
В § 38 уже было отмечено, что поступательное движение молекул газа всегда квазиклассично, причем энергию молекулы можно написать в виде
Ч (Р„ РУ, Рг) = Pl+fm+pl + ej, (42,1)
где первый член есть кинетическая энергия ее поступательного движения, а посредством г'к обозначены уровни энергии, соответствующие вращению молекулы и ее внутреннему состоянию; s'k не зависит ни от скоростей, ни от координат центра инерции молекулы (мы предполагаем, что никакого внешнего поля нет).
Статистическую сумму под знаком логарифма в формуле (41,4) мы должны заменить теперь выражением
?JM-^)5&"-"(&r?'"*'r <ед
(интегрирование по dV = dx dy dz производится по всему объему газа V). Для свободной энергии получаем
Г eV (mT -e'Jr'\
F = -NT\n][ir{^) £е к' ]• (42,3)
Стоящая здесь сумма, разумеется, не может быть вычислена в общем виде, без каких-либо предположений о свойствах молекул.
Существенно, однако, что она представляет собой функцию только от температуры. Поэтому зависимость свободной энергии от объема полностью определяется формулой (42,3), что дает возможность получить из нее ряд существенных общих результатов о свойствах идеального газа (не находящегося во внешнем поле).
Выделяя в (42,3) член, содержащий объем, напишем эту формулу в виде
F = -NT\n% + Nf(T), (42,4)
где / (Г) — некоторая функция температуры. Для давления газа получаем отсюда
р _ d_F_ _ NT dV ~ V '
ИЛИ
PV=NT. (42,5)
Мы получили, таким образом, известное уравнение состояния идеального газа (уравнение Клапейрона). Если температура измеряется в градусах, то1)
PV=NkT. (42,5а)
Зная F, можно найти также и другие термодинамические величины. Так, термодинамический потенциал равен
ф = — NT\n~- + Nf (T)+PV.
Заменяя V через Р иТ согласно (42,5) (Ф должно быть выражено как функция от Р и Т) и вводя новую функцию температуры X(T) = f(T) — TltiT, получаем
Ф = NT InP + N%(T). (42,6)
Энтропия определяется как
5 = - § = N In -~-Nf (Т) (42,7)
или как функция Р и Т
S = -d§ = -N\nP-Nt'(T). (42,8)
Наконец, энергия равна
E = F + TS = Nf(T)—NTf'(T). (42,9)
х) Для грамм-молекулы газа (/V = 6,023 • 1023—число Авогадро) произведение R — Nk называется газовой постоянной:
R = 8,314-Ю7 эрг/град.
Мы видим, что энергия является функцией только от температуры газа (то же самое относится и к тепловой функции W = Е + PV= =E + NT). Это обстоятельство, впрочем, заранее очевидно—поскольку молекулы идеального газа предполагаются не взаимодействующими друг с другом, то изменение их среднего взаимного расстояния при изменении общего объема газа не может сказаться на его энергии.
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 472; Нарушение авторских прав?; Мы поможем в написании вашей работы!