
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ol — V2X 35 страница
|
|
|
|
J \ In [cj* + с2 (©? + со!)] da, d(Da, о
где сх, с2—постоянные. Произведя интегрирование, найдем окончательно, что вблизи точки перехода термодинамический потенциал имеет вид
фъа-I Ь(Т-Тс)Чп\Т-Тс\, (151,13)
а) В рассматриваемой модели температура влияет только на упорядоченность ориентации диполей, но не на расстояния между ними («коэффициент теплового расширения» решетки равен нулю). В таком случае безразлично, говорить ли о свободной энергии или о термодинамическом потенциале.
где a, b—снова постоянные (причем Ь >0). Сам потенциал непрерывен в точке перехода, а теплоемкость обращается в бесконечность по закону
СтЬЫ\Т — Те\, (151,14)
симметричному по обе стороны точки перехода.
Роль параметра порядка ц в рассмотренной модели играет средний дипольный момент в узле (спонтанная поляризация решетки), отличный от нуля ниже точки перехода и равный нулю выше ее. Температурная зависимость этой величины тоже может быть определена; вблизи точки перехода параметр порядка стремится к нулю по закону
л =const(rc—7')|/8 (151,15)
(L. Onsager, 1947) [46]).
Корреляционная функция определяется как среднее значение произведения флуктуации дипольного момента в двух узлах решетки. Корреляционный радиус оказывается стремящимся к бесконечности при Т—>Те по закону 1/\Т — Тс\, а в самой точке Т = ТС корреляционная функция убывает с расстоянием по закону
< AeklДаи„ > со [(* -m)[47] + (I-п)*]- >/в.
Эти результаты, а также результаты решения задачи о свойствах той же модели во внешнем поле показывают, что ее поведение вблизи точки фазозого перехода удовлетворяет требованиям гипотезы о масштабной инвариантности. При этом критические индексы имеют следующие значения:
а = 0, 6 = 1/8, 7 = 7/4, 6 = 15, е = 0,
р=8/15, v = l, £ = 1/4 (151,1Ь)
(индекс £ определен согласно (148,7) с d=2)[48]).
§ 152. Ван-дер-ваальсова теория критической точки
В § 83 уже было отмечено, что критическая точка фазовых переходов между жидкостью и газом является особой точкой для термодинамических функций вещества. Физическая природа этой особенности подобна природе особенности в точках фазового перехода второго рода: подобно тому, как в последнем случае она связана с возрастанием флуктуации параметра порядка, так при приближении к критической точке возрастают флуктуации плотности вещества. Эта аналогия в физической природе приводит также и к определенной аналогии в возможном математическом описании обоих явлений, о чем будет идти речь в следующем параграфе.
Предварительно, однако, в качестве необходимой предпосылки рассмотрим описание критических явлений, основанное на пренебрежении флуктуациями. В такой теории (аналогичной приближению Ландау в теории фазовых переходов второго рода) термодинамические величины вещества (как функции переменных V и Т) предполагаются не имеющими особенности, т. е. могут быть разложены в степенные ряды по малым изменениям этих переменных. Все дальнейшие излагаемые в этом параграфе результаты являются поэтому следствием лишь обращения в нуль производной (dP/dV)r
Прежде всего выясним условия устойчивости вещества при
U)r-0. (152,1)
При выводе термодинамических неравенств в § 21 мы исходили из условия (21,1), из которого было получено неравенство (21,2), выполняющееся при условиях (21,3—4). Интересующему нас теперь случаю (152,1) соответствует особый случай условий экстремума, когда в (21,4) стоит знак равенства:
Квадратичная форма (21,2) может быть теперь, в зависимости от значений SS и 6V, как положительной, так и равной нулю; поэтому вопрос о том, имеет ли величина Е—ToS-\-P0V минимум, требует дальнейшего исследования.
Мы должны, очевидно, исследовать именно тот случай, когда в (21,2) стоит знак равенства:
^(6S)»+2^eS6V-f§^(6V)«=0. (152,3)
Принимая во внимание (152,1), это равенство можно переписать следующим образом:
(S65+bv)2- -иг [б ж]2=£ =о-
<32£ _
dS [49] dS
Таким образом, равенство (152,3) означает, что мы должны рассматривать отклонения от равновесия при постоянной температуре (6Г = 0).
При постоянной температуре исходное неравенство (21,1) принимает вид: 8F + P6V>0. Разлагая 8F в ряд по степеням
d2F /дР\
6V и учитывая, что предполагается — (^pL^0, находим
Для того чтобы это неравенство было справедливо при любом 6V, должно быть!)
{Ш)т=0' {m)r<°- <152'4)
Обратимся теперь к исследованию уравнения состояния вещества вблизи критической точки. При этом вместо переменных Т и V будет удобнее пользоваться переменными Тип, где п — плотность числа частиц (число частиц в единице объема). Введем также обозначения
t=T-TKV, р = Р—Ркр, г| = п-пкр. (152,5)
В этих переменных условия (152,1) и (152,4) записываются как
В=°- №),><> (152,6)
Ограничиваясь первыми членами разложения по малым t и т), напишем зависимость давления от температуры и плотности в виде
p = W+2arr] + 4£r|s (152,7)
с постоянными а, Ь, В. Членов ~ т) и ~ и2 в этом разложении нет в силу первых двух из условий (152,6), а в силу третьего В > 0. При t > 0 все состояния однородного тела устойчивы (разделения на фазы нигде не происходит), т. е. должно быть (dp/dr\)t > 0 при всех и; отсюда следует, что а > 0. Членов разложения ~ trf и ~ t2r\ можно не выписывать, как заведомо малых по сравнению с членом ~ tr\; сам же член tv должен быть оставлен, поскольку он входит в необходимую ниже
производную
др\
о>| It
-2at + 125п[50].
(152,8)
 Выражение (152,7) определяет изотермы однородного вещества вблизи критической точки (рис. 73). Эти изотермы имеют вид, аналогичный ван-дер-ваальсовым (рис. 19). При t < 0 они проходят через минимум и максимум, а равновесному переходу жидкости в газ отвечает горизонтальный отрезок (AD на нижней
Выражение (152,7) определяет изотермы однородного вещества вблизи критической точки (рис. 73). Эти изотермы имеют вид, аналогичный ван-дер-ваальсовым (рис. 19). При t < 0 они проходят через минимум и максимум, а равновесному переходу жидкости в газ отвечает горизонтальный отрезок (AD на нижней
изотерме), проведенный согласно условию (84,2). Понимая в этом условии под V молекулярный объем
| п |
| п |
7 - 1 1 (152,9)
v--
кр
запишем его в виде
D г)г
jnd/7 = jr,(|2.)(dr) = 0. (152,10)
А л,
После подстановки (152,8) это
Рис. 73. условие приводит к следующим
значениям плотности двух находящихся в равновесии друг с другом фаз:
Лх = -ч,= Уж-' <152'П)
Плотности же ц[ и г)2, соответствующие границам метастабильных областей (точки В и С на рис. 73) определяются условием (dp/dx\)t = 0, откуда находим1)
6В ■
(152,12)
Подстановка (152,11) обращает сумму двух последних членов в (152,7) в нуль. Поэтому
p = bt (t<0) (152,13)
есть уравнение кривой равновесия жидкости и пара в плоскости р, t (и поэтому b > 0)[51]). Согласно уравнению Клапейрона — Клаузиуса (82,2) вблизи критической точки теплота испарения
| х) В теории, учитывающей особенности термодинамических величин на границе метастабильных состояний, никакой кривой ВС вообще нет. |
q^bT^-^-. (152,14)
Из (152,11) следует поэтому, что при t—*0 эта теплота стремится к нулю по закону
q^V~t. (152,15)
Из формулы (16,10) следует, что в критической точке, вместе с обращением в нуль (dp/dr\)t, обращается в бесконечность теплоемкость Ср. С учетом (152,8) найдем, что
^^aT+W' (152Л6)
В частности, для состояний на кривой равновесия имеем т) с/э V—t, и потому Срсл(— t)' [52] .
Наконец, рассмотрим в рамках излагаемой теории флуктуации плотности вблизи критической точки. Необходимые для этого общие формулы были уже получены в § 116, а для их применения надо лишь установить конкретный вид величины AFn—изменения полной свободной энергии тела при его отклонении от равновесия.
Представим AFa в виде
AFa=l(F-F)dV,
где F—свободная энергия, отнесенная к единице объема, a F — ее среднее значение, постоянное вдоль тела. Разложим F—F по степеням флуктуации плотности Ап = п—п (или, что то же, Дг) = г) — г|) при постоянной температуре. Первый член разложения пропорционален An и при интегрировании по объему обращается в нуль в силу неизменности полного числа частиц в теле. Член второго порядка[53]):
| \дп2)т \дп)т п \дп)т (поскольку при r = const: dp, = odP, где v= Цп—молекулярный объем). |
Наряду с этим членом, обращающимся в самой критической точке в нуль, должен быть учтен еще и другой член второго порядка по An, связанный с неоднородностью тела с флуктуирующей плотностью. Не повторяя в этой связи изложенных уже в § 146 рассуждений, сразу укажем, что это—член, квадратичный по первым производным от An по координатам; в изотропной среде такой член может быть лишь квадратом градиента. Таким образом, мы приходим к выражению вида *)
Представив теперь An в виде ряда Фурье (116,9), приведем это выражение к виду (116,10) с функцией
и затем, согласно (116,14), находим фурье-образ искомой корреляционной функции:
v (k)==^[at + вВц +gnKVfi*]-* (152,18)
(ввиду малости знаменателя этого выражения, слагаемым 1 в v(&) можно пренебречь). Эта формула полностью аналогична с (146,8). Поэтому корреляционная функция v(r) в координатном представлении имеет тот же вид (146,11) с корреляционным радиусом
В частности, на критической изохоре (rj = 0): rccr>t~X12.
§ 153. Флуктуационная теория критической точки
Полученные в предыдущем параграфе формулы позволяют установить определенную аналогию между термодинамическим описанием свойств вещества вблизи критической точки и вблизи точек фазового перехода второго рода.
| ]) Тот факт, что AFa оказалось выраженным в виде интеграла от функции точки в теле (а не от функции двух точек, как в общем выражении (116,8)), связан с предположением о медленности изменения An — рассматриваются длинноволновые компоненты флуктуации плотности. |
Для этого будем, в духе теории Ландау, сначала рассматривать г) не как определенную функцию Р и Т, а как независимую переменную, равновесное значение которой устанавливается минимизацией некоторого термодинамического потенциала Ф(Р, Т, т]). Последний следует подобрать таким образом, чтобы эта минимизация действительно приводила к правильному урав-
нению состояния (152,7). Этому требованию удовлетворяет выражение *)
Ф (Р, Т, л) = Ф0 (Р, Т) + 4 [- (Р-Ы) ц+atrf+ВЧ«]. (153,1)
пкр
Сравнив (153,1) с (144,3), мы видим теперь, что существует аналогия между описанием фазового перехода второго рода во внешнем поле в теории Ландау и описанием критической точки между жидкостью и газом в ван-дер-Ваальсовой теории. При этом роль параметра порядка во втором случае играет изменение плотности вещества г\ = п—/гкр, а роль внешнего поля — разность
h = p—bt. (153,2)
Если Ф(г, h) есть термодинамический потенциал тела вблизи точки фазового перехода второго рода (при некотором фиксированном значении давления!), то выражение <D(t, р—Ы) даст вид термодинамического потенциала вещества вблизи критической точки. Все сказанное в § 146 о способе перехода от потенциала Ф к потенциалу Q относится к любому случаю, так что аналогия остается и для потенциалов Q в обеих задачах.
В § 147 было показано, каким образом можно перейти от термодинамического потенциала Q в теории Ландау к эффективному гамильтониану, описывающему фазовый переход в точной флуктуационной теории. Поэтому указанная аналогия позволяет ожидать, что и законы поведения термодинамических величин вблизи критической точки совпадают (с соответствующей заменой смысла т) и ft) с предельными законами во флуктуационной области фазового перехода второго рода во внешнем поле (описывающегося всего одним параметром порядка).
| г) Несущественный для дальнейшего коэффициент перед квадратной скобкой выбран так, чтобы после минимизации выражение (153,1) переходило в правильный потенциал ф(р, т). Может показаться странным отсутствие в (153,1) симметрии относительно put, проявляющееся в отсутствии члена с р в коэффициенте при r\z. В действительности член с т)а существен, лишь если мал коэффициент р—bt при Г); в таком случае можно с равным правом писать ah)2 или арг\г/Ь. |
Следует сразу же подчеркнуть, что такое отождествление заведомо может иметь лишь приближенный характер. В теории фазовых переходов, основанной на эффективном гамильтониане (147,6), имеет место точная симметрия по отношению к преобразованию h—►—h, т)—►— и (связанная с тождественным отсутствием члена третьего порядка ~г|8). В теории же критической точки такая симметрия является лишь приближенной; отсутствие в (153,1) (а потому и в эффективном гамильтониане) членов, нарушающих эту симметрию, связано лишь с пренебрежением ими как малыми по сравнению с остальными членами. Поэтому можноутверждать лишь, что должны совпадать главные члены в предельных зависимостях в обеих задачах [54]).
В теории фазовых переходов при t >0 и п = 0 имеем т) = 0, а при t <0 и h—>-0 находятся в равновесии две фазы с отличными от нуля значениями параметра порядка и г)2, причем r)t = — tj2 (точки А и А' на рис. 64,6, стр. 499); последнее равенство является при этом точным следствием отмеченной выше симметрии эффективного гамильтониана. В случае критической точки этим свойствам отвечает равенство
p—bt = 0, (153,3)
определяющее критическую изохору (т) = 0, т. е. п = /гкр) при t > О и линию равновесия жидкости и пара при t < 0. Равенство же т]2 = — г)! означает здесь симметричность линии фазового равновесия в плоскости t, т), а продолжение аналогии позволяет утверждать, что эти значения стремятся к нулю при t—>-0 по закону
т]1 = -Л2~(-0р (153,4)
с тем же показателем, что и в (148,5)[55]). Но поскольку инвариантность эффективного гамильтониана по отношению к изменению знака т) (при h = 0) имеет лишь приближенный характер, то возникает вопрос о предельном законе температурной зависимости суммы T^i + y]!- На основе сказанного до сих пор можно утверждать лишь, что эта величина—более высокого порядка малости, чем сами % и г|2; мы вернемся к этому вопросу в конце параграфа.
На рис. 74 изображена фазовая диаграмма в плоскости т), t. Область расслоения на две фазы заштрихована, а ее граница изображена симметричной кривой, как это соответствует закону (153,4).
Теплота испарения связана с разностью —т}2 формулой (152,14). Поэтому она стремится при \t\—>-0 к нулю по тому же закону
qn>(— tf. (153,5)
Общее уравнение состояния однородного вещества во всей окрестности критической точки (в плоскости ц, Т) можно представить в виде
(153,6)
где верхний и нижний знаки относятся к т) > 0 и л < О (В. Widom, 1965). Эта формула соответствует уравнению (148,18) теории фа-
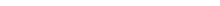 зовых переходов (разрешенному относительно К).
зовых переходов (разрешенному относительно К).
К функции f(x) в (153,6) относятся такие же соображения об аналитичности, о которых говорилось в § 149 в случае переходов второго рода.
Так, при заданном отличном от нуля значении т] изменение t нигде не приводит к прохождению через критическую точку, и потому значение t = 0 не является особой точкой функции (153,6). Она разложима, следовательно, по целым степеням t. Другими словами, функция f(x) разлагается по целым степеням х. Первые члены разложения: / (х) оо 1 + схх, так что уравнение состояния принимает вид
P~bt™±\4]f[\+c1j-Lub+...] при UKhr (153,7)
(первый член разложения соответствует определению (148,10) для случая сильного поля в теории фазовых переходов). На рис. 74 тонкими пунктирными линиями схематически показаны границы области, к которой относится это уравнение состояния. В этой области можно выделить еще два предельных случая. Если t<^p (в частности, на критической изотерме, т.е. на линии [56] = 0), то
р оо ± | т] j6
(153,8)
| (153,9) |
Если же t^>p (в частности, на критической изобаре, т. е. на линии р = 0), то
/оо±Ыв
Сравнение (153,8) и (153,9) обнаруживает, как и следовало, симметрию между put1).
Аналогичным образом при заданном отличном от нуля значении t не является особой точкой нулевое значение переменной и. Поэтому при t > 0 и г)—*0 функция (153,6) разложима по целым степеням rj, причем разложение может содержать только нечетные степени tj,— снова ввиду симметрии эффективного гамильтониана относительно одновременного изменения знаков ri и ft. Отсюда следует, что1)
/ (х)е\эхРв(С1л:-Р+СзЛ;-3В+ • • •) при х—юо;
множитель хРа сокращает нецелую степень т)6, а переменная разложения х-$сох\. Таким образом, уравнение состояния принимает вид
р—bteof*[c1i\+cti\4—»+.. ■].при *>|т||1/р (153,10)
(учтено равенство 66 = 6 + 7 (148,14)). Область применимости этого уравнения тоже схематически показана на рис. 74. Первый член разложения (153,10) соответствует соотношению т, = %hcvht~v теории фазовых переходов в слабом поле.
Поведение производных различных порядков от р по г) (при t = const) зависит от направления (в плоскости т|, t), по которому происходит приближение к критической точке. При приближении вдоль критической изотермы (£ = 0) функция р(п) дается формулой (153,8). Фактическое значение индекса 6 лежит между 4 и 5. Поэтому вдоль критической изотермы стремится к нулю не только (др/дг\)ь но и производные нескольких следующих порядков.
При приближении к критической точке по всякому другому направлению (лежащему вне области расслоения на две фазы, т. е. вдоль лучей ^ = const -1 "П | с const > 0) выполняется неравенство £^>|il|l/p> поскольку фактически 1/Р > 1. Из уравнения состояния имеем тогда
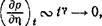
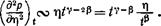
|
| h = p—bt, (153,11) |
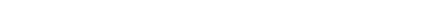
и для второй производной
написанного прямо по аналогии с формулой (149,7) теории фазовых переходов (с тождественной заменой показателей: dv = 2—а, p/v= 1/(6+у)). Не повторяя заново всех рассуждений, выпишем сразу (по аналогии с (149,9—10)) нужные для дальнейшего предельные выражения 1):
Ф (p,t) со при t>0, h—-0, (153,12)
Ф(р,ОочЭ(-Ог-«[1+с1р!^] при t < 0, А—»-0. (153,13)
Двукратным дифференцированием выражения (153,12) находим теплоемкость на критической изохоре (линия р—bt = 0, >0):
С„оэ[57]-«. (153,14)
Поскольку дифференцирование при h = 0, t > 0 означает дифференцирование при т] = 0, то это—теплоемкость при постоянном объеме. Таким образом, теплоемкость Cv на критической изохоре ведет себя как теплоемкость Ср в фазовом переходе второго рода!
Согласно формуле (16,10) имеем
г —г соЁЕЁ1&
°» (dp/dr\)f
При приближении к критической точке производная (dp/dt)^ стремится к постоянному пределу Ъ, в чем легко убедиться с помощью уравнений состояния (153,7) или (153,10). Поэтому
C^(l-);1. (153,15)
Расходимость этого выражения при приближении к критической точке—более сильная, чем расходимость Cv; поэтому член С„ опущен по сравнению с Ср.
Наконец, остановимся на вопросе об асимметрии кривой сосуществования фаз вблизи критической точки (В. Л. Покровский, 1972).
Как уже было отмечено, эта асимметрия может появиться только в результате учета в эффективном гамильтониане членов, нарушающих его симметрию относительно преобразования
h—>-—h, г)—>■—г). Первый из таких членов: ^r^/i[58]); его появление можно формально представить как результат замены в эффективном гамильтониане t на /+ const-h; тогда
arft —+ ацг (t+ const • Л).
Эта замена в эффективном гамильтониане приведет к такой же замене в термодинамическом потенциале, выраженном в функции от h и t:
Ф(к, t)—>0(h, t+const-h).
 Вблизи кривой сосуществования фаз функция Ф (h, t) дается выражением (153,13); искомая же плотность вычисляется дифференцированием по h. В результате получим
Вблизи кривой сосуществования фаз функция Ф (h, t) дается выражением (153,13); искомая же плотность вычисляется дифференцированием по h. В результате получим
| Vr\\n |
| ■±о- |
-j- (2—а) ■ const • (— г)[59] ~а.
2>7 Первый член дает уже известные нам значения (153,4) плотностей на симметричной кривой сосуществования; этот член исчезает в сумме гц + т^, для которой остается
% + Я[60]"*, (153,16)
| следует тогда прямо из точного соотношения а+2(5 + у=2. |
чем и определяется искомый закон. Фактически 1—а>6[61]), так что асимметрия действительно относительно мала: (% + т)2)/т}1—>-0 при t—*0. Сумма г), фактически положительна; это значит, что ее учет деформирует кривую сосуществования, как это показано на рис. 75.
ГЛАВА XV
ПОВЕРХНОСТИ
§ 154. Поверхностное натяжение
Везде в предыдущем мы пренебрегали эффектами, связанными с наличием поверхностей раздела между различными телами*). Поскольку при увеличении размеров (числа частиц) тела поверхностные эффекты растут гораздо медленнее, чем объемные, то пренебрежение ими при изучении объемных свойств тел вполне оправдано. Существует, однако, ряд явлений, которые связаны именно со свойствами поверхностей раздела.
Термодинамические свойства поверхности раздела полностью характеризуются одной величиной (функцией состояния тел), определяемой следующим образом. Обозначим площадь поверхности раздела посредством § и рассмотрим процесс обратимого изменения Этой площади на бесконечно малую величину d-З. Работа, затрачиваемая при таком процессе, очевидно, пропорциональна dh, т. е может быть написана в виде
dR = adu. (154,1)
Определяемая таким образом величина а и представляет собой основную характеристику поверхности раздела; она называется коэффициентом поверхностного натяжения.
Формула (154,1) в точности соответствует формуле dT? = — PdV для работы при обратимом изменении объема тела. Можно сказать, что а играет для поверхности такую же роль, как давление для объема. В частности, легко показать, что на единицу длины контура, ограничивающего какой-либо участок поверхности раздела, действует сила, по величине равная а и направленная касательно к поверхности по внутренней нормали к контуру.
| 1) В действительности, конечно, соприкасающиеся фазы разделены узким переходным слоем; не интересуясь его структурой, мы можем рассматрив«ть его как геометрическую поверхность. |
Мы Подразумеваем при этом, что а > 0; что это действительно так, доказывают следующие соображения. Если бы было а < 0, то на ограничивающий поверхность контур действовали бы силы, направленные по внешней нормали к нему, т. е. стремящиеся «растянуть» поверхность; другими словами, поверхность раздела двух фаз стремилась бы неограниченно возрастать, т. е. фаз вообще не существовало бы, так как они смешались бы. Напротив при а > О поверхность раздела стремится принять наименьшее возможное (при данном объеме обеих фаз) значение. Поэтому, например, если одна изотропная фаза погружена в другую, то она примет форму шара (при этом, конечно, мы пренебрегаем действием внешнего—гравитационного поля).
Обратимся к более подробному изучению поверхностного натяжения на границе раздела двух изотропных фаз—жидкости и пара—одного и того же чистого вещества. Если речь идет о поверхности раздела двух фаз, находящихся в равновесии друг с другом, то следует помнить, что их давление и температура связаны определенной функциональной зависимостью—уравнением кривой фазового равновесия. При этом а является функцией, по существу, не от двух, а всего от одной независимой переменной.
Без учета поверхностных эффектов дифференциал энергии системы из двух фаз (одного и того же вещества) при заданном объеме V всей системы имеет вид dE = Т dS + р, dN (в равновесии температуры Т и химические потенциалы р обеих фаз одинаковы, что и дает возможность написать это равенство для всей системы сразу). При учете же наличия поверхностных эффектов к правой стороне этого равенства надо, очевидно, прибавить еще выражение (154,1):
dE = TdS + ndN + ad§. (154,2)
В качестве основной термодинамической величины, однако, удобно выбрать не энергию, а потенциал Q—термодинамический потенциал по отношению к независимым переменным Т, р (и объему V). Удобство этой величины в данном случае связано с тем, что Т и р,—величины, имеющие одинаковое значение в обеих фазах (между тем как давления при учете поверхностных эффектов уже, вообще говоря, не совпадают—см. § 156). Для ее дифференциала Q (снова при V= const) имеем
dQ = — SdT—Ndp+adS. (154,3)
Термодинамические величины (такие, как Е, Q, S и т. п.) рассматриваемой системы можно представить в виде суммы двух частей—объемной и поверхностной. Такое разделение, однако, не однозначно, так как числа частиц в каждой из фаз определены лишь с точностью до числа частиц, находящихся в переходном слое между фазами; то же самое относится и к объемам фаз. Между тем эта неопределенность—как раз того же порядка величины, что и интересующие нас поверхностные эффекты. Мы сделаем разделение однозначным, подчинив его следующему естественному условию: объемы Vx и V2 обеих фаз определяются так, чтобы наряду с равенством V, f V2 = V (где V—полный объем системы) имело место также и равенство
n,V, + n2V2 = N,
где N — полное число частиц в системе, а /1,-/1,(11, Т) и п2 = = n2(p, Т) — объемные плотности числа частиц в каждой из фаз (рассматриваемых как неограниченные). Эти два равенства фиксируют выбор объемов V„ V2 (и чисел частиц N, = tijV,, N2 = n2V2), а тем самым и значения объемных частей всех других термодинамических величин. Будем отмечать объемные части индексом О, а поверхностные—индексом s; для числа частиц имеем по принятому нами определению Ns = 0.
Из (154,3) имеем при постоянных Т и р, (а потому и постоянном a) dQ = ad§; поэтому ясно, что Qs = a§. Таким образом,
Q = Q0 + a§. (154,4)
Поскольку энтропия 5 = — 8> т0 ее поверхностная часть1)
Далее находим поверхностную свободную энергию; поскольку F = Q + N\i, и Ns = 0, то
Ft = ai. (154,6)
Поверхностная же энергия
E, = F, + TSa= [*-T%r) S. (154,7)
Количество тепла, поглощающееся при обратимом изотермическом изменении площади поверхности от §, до §2, равно
Q = Т (SS2-SS,) = - Т^г («,-«,). (154,8)
Сумма тепла Q и работы R = a(§2—8,) при этом же процессе равна, как и следовало, изменению энергии Es2 — Esl.
х) Коэффициент а есть функция всего одной независимой переменной; для такой функции понятия частных производных по р. и по Т сами по себе не имеют смысла. Однако тем самым, что мы положили
| (да/дц.)г = 0; в э- da_ / да \ дТ~\дт)»' |
|
|
|
|
|
Дата добавления: 2014-11-07; Просмотров: 378; Нарушение авторских прав?; Мы поможем в написании вашей работы!