
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Первое начало термодинамики
|
|
|
|
Термодинамика рассматривает полученные опытным путем фундаментальные законы (т.н. начала термодинамики), относящиеся к свойствам макроскопических тел, строение которых не рассматривается.
Внутренняя энергия термодинамической системы – это энергия теплового движения молекул:
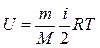 ,
,
где 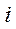 – число степеней свободы (число независимых координат, определяющих положение системы в пространстве):
– число степеней свободы (число независимых координат, определяющих положение системы в пространстве): 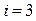 для одноатомной молекулы,
для одноатомной молекулы, 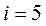 для двухатомной молекулы,
для двухатомной молекулы, 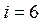 для молекул, состоящих из трех или более атомов.
для молекул, состоящих из трех или более атомов.
Теплоемкостью тела называется величина, равная количеству теплоты, которую нужно сообщить телу, чтобы повысить его температуру на один кельвин:
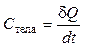 .
.
У дельной теплоемкостью вещества 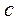 называется т еплоемкость единицы массы
называется т еплоемкость единицы массы
М олярной теплоемкостью 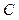 называется. теплоемкость одного моля вещества
называется. теплоемкость одного моля вещества
Удельная и молярная теплоемкости связаны:
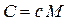 ,
,
где 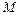 – молярная масса.
– молярная масса.
Теплоемкость газа зависит от условий, при которых происходит его нагревание: 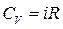 – молярная теплоемкость при постоянном объеме,
– молярная теплоемкость при постоянном объеме, 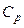 – при постоянном давлении. Они связаны уравнением Майера:
– при постоянном давлении. Они связаны уравнением Майера:
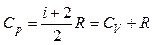 .
.
Первое начало термодинамики: количество теплоты, сообщаемое системе, затрачивается на приращение внутренней энергии системы и совершение системой работы над внешними телами
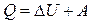 ,
,
где 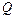 – количество теплоты, полученное системой,
– количество теплоты, полученное системой,  – изменение внутренней энергии системы,
– изменение внутренней энергии системы, 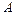 – работа, совершаемая системой против внешних сил.
– работа, совершаемая системой против внешних сил.
Если температура идеального газа массой 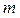 изменилась на величину
изменилась на величину 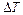 , то его внутренняя энергия изменилась на величину:
, то его внутренняя энергия изменилась на величину:
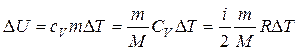 .
.
Если при постоянном давлении 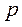 газ нагревается на
газ нагревается на 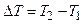 , то его объем возрастает от
, то его объем возрастает от  до
до 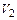 и газ совершает работу:
и газ совершает работу:
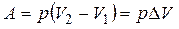 .
.
Применим первое начало термодинамики с уравнением состояния Клапейрона–Менделеева к различным процессам:
При изобарическом процессе (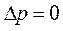 ):
):
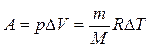 .
.
Если в процессе изобарического расширения к газу подводилось тепло, то согласно первому началу термодинамики:
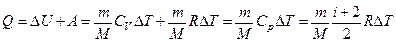 .
.
При изотермическом процессе (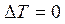 ) все тепло, получаемое газом, идет на совершение работы, так как в этом случае
) все тепло, получаемое газом, идет на совершение работы, так как в этом случае 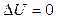 :
:
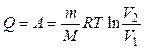 .
.
При изохорическом процессе (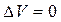 ) все тепло, получаемое газом, идет на изменение внутренней энергии последнего:
) все тепло, получаемое газом, идет на изменение внутренней энергии последнего:
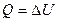 .
.
В этом случае  , а количество теплоты, получаемое или отдаваемое газом, может быть определено по формуле:
, а количество теплоты, получаемое или отдаваемое газом, может быть определено по формуле:
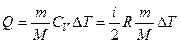 .
.
Адиабатический процесс происходит при изменении объема газа без теплообмена с окружающей средой. В этом случае давление 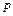 и объем
и объем 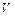 постоянной массы газа связаны уравнением Пуассона:
постоянной массы газа связаны уравнением Пуассона:
 , где
, где  .
.
Для перехода к переменным 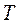 и
и 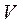 можно использовать уравнение Клапейрона– Менделеева и тогда получим:
можно использовать уравнение Клапейрона– Менделеева и тогда получим:
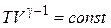 .
.
При адиабатическом процессе (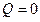 ) работа производится за счет внутренней энергии газа: при расширении газ охлаждается и наоборот. Работа в этом случае определяется выражением:
) работа производится за счет внутренней энергии газа: при расширении газ охлаждается и наоборот. Работа в этом случае определяется выражением:
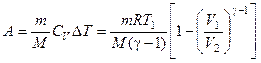 ,
,
где 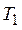 и
и 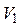 – первоначальные значения температуры и объема газа,
– первоначальные значения температуры и объема газа, 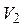 – объем газа в конце процесса.
– объем газа в конце процесса.
При политропическом процессе теплоемкость тела остается постоянной величиной (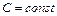 ). В этом случае давление
). В этом случае давление 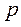 и объем
и объем 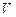 связаны уравнением политропы:
связаны уравнением политропы:
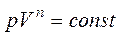 , где
, где  .
.
Величина 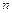 называется показателем политропы.
называется показателем политропы.
Коэффициент полезного действия тепловой машины
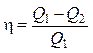 ,
,
где 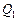 – количество теплоты, полученное от нагревателя,
– количество теплоты, полученное от нагревателя, 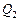 – количество теплоты, отданное холодильнику.
– количество теплоты, отданное холодильнику.
Для идеального цикла Карно:
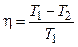 ,
,
где 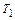 и
и 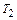 – температуры нагревателя и холодильника соответственно.
– температуры нагревателя и холодильника соответственно.
Задача 8.1. Под поршнем цилиндра, расположенного вертикально, находится 200 г воздуха, который при сообщении ему количества теплоты 100 Дж изобарически нагрелся на 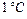 . Если воздух - идеальный газ, то чему равны работа воздуха по поднятию поршня и увеличение его внутренней энергии?
. Если воздух - идеальный газ, то чему равны работа воздуха по поднятию поршня и увеличение его внутренней энергии?
Дано: Решение:
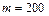 г г
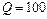 Дж Дж
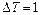 К К
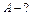
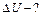
| Количество теплоты, сообщенное воздуху, пошло на увеличение его внутренней энергии и на совершение работы против внешних вил. Из первого закона термодинамики
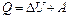 следует:
следует:
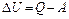 . .
|
Работа расширения воздуха при постоянном давлении: 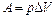 ,
,
где 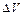 – изменение объема воздуха.
– изменение объема воздуха.
Используя уравнения Клапейрона–Менделеева
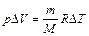 ,
,
получим
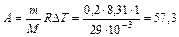 Дж.
Дж.
Увеличение внутренней энергии равно:
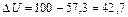 Дж.
Дж.
Ответ:
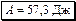 ,
, 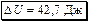 .
.
Задача 8.2. Идеальная тепловая машина Карно совершает за один цикл работу 800 Дж и отдает за один цикл холодильнику количество теплоты 3,2 кДж при температуре 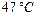 . Найти температуру нагревателя.
. Найти температуру нагревателя.
Дано: Решение:
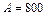 Дж Дж
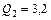 кДж кДж
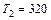 К К
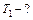
| Работа, совершаемая тепловой машиной за один цикл, определяется выражением:
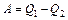 , (1)
где , (1)
где  – количество теплоты, полученное от нагревателя, – количество теплоты, полученное от нагревателя, 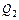 – количество теплоты, отданное холодильнику. Тогда – количество теплоты, отданное холодильнику. Тогда
|
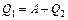 .
.
Используя определение КПД тепловой машины
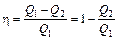 ,
,
получим:
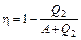 . (2)
. (2)
С другой стороны, для цикла Карно
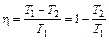 ,
,
откуда получаем температуру нагревателя
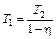 . (3)
. (3)
Подставляя (2) в (3), получим ответ
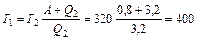 К.
К.
Ответ:
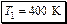 или
или 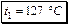 .
.
Рекомендуемый учебник: И.В. Савельев. Курс физики. Том.1. Механика. Молекулярная физика
|
|
|
|
|
Дата добавления: 2014-10-22; Просмотров: 425; Нарушение авторских прав?; Мы поможем в написании вашей работы!