
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Буферные растворы
Тема 3. электролиты. гидролиз солей.
Электролитами называются вещества, которые в расплавленном или растворенном состоянии проводят электрический ток. К электролитам относятся соли, кислоты и основания. Молекулы электролита в растворе или расплаве распадаются на ионы – положительно заряженные катионы (К+) и отрицательно заряженные анионы (А-), поэтому растворы или расплавы электролитов проводят электрический ток. Процесс распада веществ на ионы называется электролитической диссоциацией. Электролиты делятся па сильные и слабые. Способность к диссоциации электролита выражается степенью диссоциации α:
α=число диссоциированных молекул/общее число растворенных молекул.
Величина α может быть выражена в долях единицы или процентах. Значением величины степени диссоциации характеризуется сила электролита. Чем больше значение α, тем более сильным является электролит. Электролит считается сильным, если значение α его в 0,1 н. растворе больше 30%, средней силы – от 30 до 3% и слабым, если α меньше 3%. К сильным электролитам относятся кислоты НСl, НВг, HI, HNО3, Н2SО4 и другие; основания NаОН, КОН, Ва(ОН)2 и другие и почти все соли. Слабые электролиты – все органические кислоты и основания, кислоты Н2S, Н2СО3, Н2SО3, НСN и другие, большинство оснований NН4ОН, Сu(ОН)2, Fе(ОН)3 и др. В отличие от сильных электролитов, которые в растворе диссоциированы практически полностью, диссоциация молекул слабых электролитов протекает обратимо и устанавливается равновесие:
КА ↔ К+ + А-.
Применяя закон действия масс, можно записать: К = Ск+ × СА-/СКА. Константа равновесия К называется константой электролитической диссоциации, которая представляет собой отношение произведения концентраций ионов к концентрации недиссоциированных молекул электролита. Чем больше К, тем лучше электролит распадается на ионы. Для данного электролита значение К постоянно при определенной температуре и в отличие от α не зависит от концентрации.
Реакции в растворах электролитов обычно протекают не между молекулами, а между ионами. Если в этих реакциях не происходит изменение зарядов ионов, входящих в соединения, то такие реакции называются ионообменными реакциями, или просто ионными. Ионные реакции протекают лишь в том случае, если в результате взаимодействия между ионами различных электролитов образуются осадки труднорастворимых веществ, газы (легколетучие вещества), слабые электролиты, комплексные ионы. Уравнения реакций в растворах электролитов рекомендуется записывать в молекулярной и ионной формах. При этом формулы сильных электролитов записывают в виде ионов, а формулы слабых электролитов и труднорастворимых (или газообразных) веществ – в виде недиссоциированных молекул. Например:
NaOH + HCl → NaCl + H2O (молекулярное уравнение);
Na++OH-+H++Cl-→Na++Cl-+Н2О (полное ионное уравнение);
H+ + OH- → H2O (краткое ионное уравнение).
Краткое ионное уравнение выражает сущность процесса.
Ионное произведение воды. Водородный показатель (рН). Вода является слабым электролитом и диссоциирует по уравнению
Н2О ↔ Н+ + ОН-.
Применение закона действия масс к процессу диссоциации воды дает возможность записать константу электролитической диссоциации:
К =([Н+] × [ОН-]) / [Н2О] = 1,82 × 10-16 (при 25оС).
Концентрация недиссоциированных молекул воды равна
1000/56 = 55,56 моль/л.
Преобразив уравнение, получаем
[Н+]×[ОН-]=К×[Н2О]=1,82×10-16×55,56 = 10-14.
Произведение концентраций ионов водорода и ионов гидроксила называется ионным произведением воды: Кв=[Н+]×[ОН-]. В воде и разбавленных водных растворах при определенной температуре ионное произведение воды является величиной постоянной. При 25°С Кв=10-14. Пользуясь ионным произведением воды, можно дать характеристику среды раствора, т. е. определить, какую реакцию имеет раствор: кислую, нейтральную или щелочную. В кислых средах [Н+]>[ОН-], в нейтральных [Н+]=[ОН-], в щелочных [Н+ ]<[ ОН-]. Для количественной характеристики среды растворов чаще всего пользуются концентрацией водородных ионов: кислый раствор – [Н+]>10-7 моль/л; нейтральный – [Н+]=10 -7 моль/л; щелочной – [Н+]<10-7 моль/л. Зная концентрацию ионов водорода, всегда можно вычислить концентрацию гидроксильных ионов по формуле ионного произведения воды.
На практике для удобства характеристики реакции растворов обычно пользуются водородным показателем рН, который равен отрицательному десятичному логарифму концентрации ионов водорода: рН = - lg [Н+]. Тогда рН различных растворов будут иметь следующие значения:
рН < 7 – среда кислая;
рН = 7 – среда нейтральная;
рН > 7 – среда щелочная.
Существуют различные методы определения водородного показателя растворов. Наибольшее распространение получили колориметрический и электрометрический методы. Колориметрический метод основан на изменении окраски индикаторов в зависимости от концентрации водородных ионов. Индикаторами называют вещества, имеющие различную окраску в зависимости от концентрации ионов водорода в растворе. Они представляют собой слабые органические кислоты или слабые основания, недиссоциированные молекулы которых имеют другую окраску, чем образуемые ими ионы. Например, недиссоциированные молекулы лакмуса – красного цвета, а образуемые им анионы – синего цвета; молекулы фенолфталеина – бесцветные, а его анионы окрашены в интенсивно малиновый цвет. Изменение окраски различных индикаторов происходит при определенных для каждого из них значениях рН. Окраска лакмуса (красный-синий) изменяется при рН=7, метилоранжа (красный-желтый) – при рН=4, фенолфталеина (бесцветный-малиновый) – при рН=9. Используя набор различных индикаторов, можно достаточно точно определить рН раствора. При электрометрическом методе определения рН применяют лабораторные рН-метры, или иономеры.
Гидролизом соли называется взаимодействие ионов растворенной соли с молекулами воды, сопровождающееся изменением рН раствора. Гидролиз может происходить в том случае, когда при взаимодействии ионов соли с ионами воды образуются слабые электролиты. Таким образом, гидролизоваться могут соли, в состав которых входят ионы слабой кислоты или катионы слабого основания, так как только такие ионы могут образовывать малодиссоциирующие соединения. Гидролизу подвергаются соли, образованные: а) сильным основанием и слабой кислотой, например, Nа2СО3; б) слабым основанием и сильной кислотой, например, NН4С1; в) слабым основанием и слабой кислотой, например, СН3СООNН4. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются, например, NаС1.
Уравнения гидролиза пишутся аналогично другим ионным уравнениям. Формулы малодиссоциирующих, малорастворимых, а также газообразных веществ пишутся в молекулярной форме, а формулы сильных электролитов – в виде составляющих их ионов. Уравнения гидролиза солей многоосновных кислот и многокислотных оснований записываются по ступеням. Типы гидролиза.
1. катионный гидролиз. соль образована слабым основанием и сильной кислотой, например, NН4Сl:
NН4С1+Н2О ↔ NН4ОН+НСl;
NH4+ + H2O ↔ NН4ОН + H+.
Гидролиз соли, образованной слабым основанием и сильной кислотой, сводится к гидролизу катиона слабого основания. В результате этого концентрация ионов Н+ в растворе становится больше концентрации ионов ОН-, и раствор приобретает кислую реакцию (рН<7).
2. анионный гидролиз. Соль образована сильным основанием и слабой кислотой, например, Nа2СО3:
Na2СO3+Н2О ↔ NaНСO3 + NaОН;
СO32- + H2O ↔ HCO3- + ОН-.
Гидролиз соли, образованной сильным основанием и слабой кислотой, сводится к гидролизу аниона слабой кислоты. Поэтому в растворе соли Nа2СО3 концентрация ионов ОН- становится больше концентрации ионов Н+, и реакция этого раствора – щелочная (рН>7);
3. Катионно-анионный гидролиз. Соль образована слабой кислотой и слабым основанием, например, СН3СООNН4:
СН3СООNН4+H2O↔СН3СООН+NН4ОН;
СН3СОО- + NН4+ + Н2О ↔ СН3СООН + NН4ОН.
Гидролиз соли, образованной слабой кислотой и слабым основанием, сводится к гидролизу как катиона слабого основания, так и аниона слабой кислоты. Реакция раствора зависит от степени диссоциации (силы электролита) образовавшихся кислоты и основания. Для данной соли она будет близкой к нейтральной (рН≈7), так как степени диссоциации обоих слабых электролитов приблизительно равны.
4. Соли, образованные сильными кислотами и сильными основаниями, например, NаС1, гидролизу не подвергаются, так как их ионы не могут давать с ионами воды Н+ и ОН- слабых электролитов.
Буферные растворы. Растворы, рН которых относительно мало изменяется при добавлении небольших количеств кислоты или основания, называются буферными. Они обычно содержат слабую кислоту и ее соль, например, СН3СООН + СН3СООК или слабое основание и его соль, например, NH4OH + NH4C1. Рассмотрим процессы диссоциации в растворе слабой кислоты и ее соли:
СН3СООН ↔ CH3COО - + Н+;
CH3COONa → CH3COO- + Na+.
При добавлении кислоты в раствор ее ионы водорода связываются в слабую кислоту
Н+ + СН3СОО- ↔ CH3COOH.
При добавлении основания в раствор гидроксид-ион связывается в слабый электролит (Н2О)
Н+ + ОН- ↔Н2О.
Образование слабых электролитов при добавлении в буферный раствор кислоты или основания и обусловливает устойчивость рН.
Константа диссоциации кислоты равна
Кд=([СН3СОО-]×[Н+])/[СН3СООН] или [СН3СОО-] /[СН3СООН]=Кд/[Н+].
Логарифмируя это уравнение, получаем
pH=pKд +lg([СН3СОО-] /[СН3СООН]).
Так как соль полностью диссоциирована, то [СН3СОО- ] = С соли.
Поскольку доля диссоциированной кислоты мала, то можно принять, что концентрация недиссоциированной кислоты примерно равна исходной концентрации кислоты, т.е. C кислоты:
[СН3СОО-] /[СН3СООН] = асоли/акислоты= с соли/ с кислоты.
Соответственно pH=pKд +lg(с соли/ с кислоты).
Рассчитаем рН рассмотренного раствора, в котором
с соли = с кислоты = 0,1 моль/л.
В этом случае рН = рК д = 4,75.
Если в этот раствор добавить НСl концентрации 10-2 моль/л, то из-за реакции H+ + Cl- + CH3COO-↔CH3COOH + Cl- концентрация соли уменьшится на 10-2 моль/л, а концентрация кислоты увеличится на 10-2моль/л. Согласно уравнению, рН раствора будет равен 4,63. Как видно, рН изменился незначительно (на 0,08 единицы). Если бы это количество НС1 добавить в дистиллированную воду, то ее рН изменился бы от 7 до 2 (на 5 единиц).
Буферирование играет важную роль в природе и технике. В организме человека рН меняется очень незначительно вследствие буферных свойств растворов во всех системах. Мало изменяется рН морской воды (рН 8,0). При проведении многих технологических процессов рН среды поддерживают постоянным с помощью буферных систем.
Таким образом, в воде происходит ее диссоциация (самоионизация) с образованием ионов водорода и гидроксида. При постоянной температуре произведение активностей ионов водорода и гидроксида является величиной постоянной. Важное значение для многих биологических и технологических процессов имеет водородный показатель среды. Его можно рассчитать, а также определить с помощью индикаторов и приборов. Значение рН можно поддерживать на практически постоянном уровне путем применения буферных смесей.
Основными буферными системами организма являются: гидрокарбонатная, гемоглобиновая, фосфатная и белковая. Все эти системы имеются в крови, где с их помощью поддерживается рН=7,40±0,05. Все буферные системы в организме взаимосвязаны.
Протолитические буферные системы крови состоят из нескольких систем. Когда кровь попадает в лёгкие, где давление кислорода при вдохе достаточно велико, она обогащается кислородом за счет связывания его в эритроцитах гемоглобином HHb с образованием оксигемоглобина HHbO2.. Оксигемоглобин, как кислота, диссоциирует легче, чем гемоглобин, анион которого, связывая катион Н+, поддерживает рН в эритроцитах. За счет HHb и при участии фермента карбоангидразы в легких параллельно происходит процесс очищения крови от летучей кислоты СО2. Уменьшение концентрации НСО3- в эритроцитах легочной крови приводит к диффузии НСО3- из плазмы в эритроцит. Вследствие этого плазма очищается от гидрокарбонат-аниона и растворенного СО2 (СО2×Н2О), так как переход НСО3- в эритроцит способствует следующим превращениям в плазме:
СО2·Н2О ↔Н2СО3↔Н++НСО3-→в эритроцит.
Поступление НСО3- в эритроциты приводит к удалению из них хлорид-анионов (для соблюдения электронейтральности этих клеток). Следует подчеркнуть, что протеканию всех приведенных реакций способствуют два физиологических процесса: вдох – поступление кислорода в кровь и выдох – выделение из крови "летучей кислоты" СО2.
Обогащенная кислородом артериальная кровь, содержащая оксигемоглобин на 65 % в ионизированном состоянии (HbO2-), а гемоглобин – на 10 % (Нb-) поступает в ткани, которые стремятся получить кислород и отдать в кровь продукты метаболизма: СО2 и избыток катионов Н+. Это приводит к протеканию следующих процессов: поступающий в кровь СО2 растворяется в плазме и эритроцитах и, реагируя с водой, образует угольную кислоту. В плазме эта реакция идет медленно, а в эритроцитах – быстро за счет участия фермента карбоангидразы. Поэтому СО2 интенсивно диффундирует в эритроциты, где происходит его связывание с образованием Н2СОз, а также карбаминогемоглобина (НЬ·CO2)-в результате взаимодействия с буферным основанием эритроцитов Нb-, при котором СО2 связывается с аминогруппами белка (глобина). Образовавшаяся в эритроцитах Н2СО3, как более сильная кислота, реагирует с другим буферным основанием – HbO2-,переводя его в неионизированное состояние ННbО2, а сама превращается в НСО3-, который диффундирует в плазму. Неионизированный оксигемоглобин легко отдает тканям необходимый кислород. Эти процессы в эритроцитах описываются следующими реакциями:
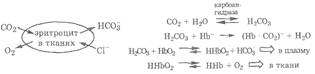
Таким образом, в тканях из эритроцитов в плазму постоянно поступает НСО3-, a из плазмы в эритроциты для соблюдения их электронейтральности диффундируют протолитически неактивные хлорид-анионы. В результате встречной диффузии этих ионов в эритроците среда менее щелочная (рН = 7,25), чем в плазме (рН = 7,40). В плазму крови из тканей поступают метаболический Н+ и СО2, а из эритроцитов – НСО3-. Буферные основания плазмы: гидрокарбонат-анион НСО3-, анион белка (Prot)- и гидрофосфат-анион НРО42-, реагируя с поступающими кислотными субстратами Н+, СО2 · Н2О и Н2СО3, нейтрализуют их благодаря следующим реакциям:
плазма крови в тканях
Н+ + НСО3- ↔ Н2СО3; Н+ + (Prot) - ↔HProt; H+ + HPO42- ↔ H2РО4-;
Н2О+СO2+(Prot)-↔HProt+HCO3-; H2O+СО3+HPO42-↔Н2РО4-+НСO3-;
Н2СО3+(Prot)- ↔HProt+НСО3- ; Н2СО3-+HPO42- ↔Н2РО4- + НСO3-.
В легких кровь очищается от НСО3- за счет превращения его в СO2 и удаления из организма. Нейтрализация кислых продуктов HProt и Н2РО4- в соответствующие им буферные основания (Prot)- и HPO42- происходит при очищении крови в почках, при этом часть фосфатов удаляется с мочой.
Совокупность рассмотренных процессов, происходящих в эритроцитах и плазме крови, обеспечивает протекание двух важнейших физиологических процессов – поддержания рН крови на уровне рН=7,35–7,45, несмотря на постоянное поступление в нее из тканей СО2 и катионов Н+, и дыхания – поступления в кровь и транспорта ею кислорода и СO2. Транспорт кислорода из легких в ткани в основном осуществляется за счет образования в эритроцитах оксигемоглобина (ННbО2), при этом 100 мл крови транспортируют 21 мл газообразного кислорода. Углекислый газ транспортируется кровью из тканей в легкие в следующих формах: HCO3- – 80 %, (Hb · СО2)- – 15 % и (СО2 · Н2О), т. е. в растворенном виде, – 5 %. При этом около двух третей общего количества СО2 находится в плазме, а одна треть - в эритроцитах. Однако в процессе переноса СО2 от тканей к легким почти весь СО2 крови должен пройти через эритроциты, т. е. войти в эритроциты и выйти из них.
Все буферные системы организма характеризуются отношением [акцептор протона]/[донор протона] = 4–20, т. е. их буферная емкость по кислоте больше, чем буферная емкость по основанию. Это отношение находится в соответствии с особенностями метаболизма человеческого организма, образующего больше кислотных продуктов, чем основных. Поэтому очень важным показателем для физиологических сред является кислотная буферная емкость Вa. При заболеваниях органов дыхания, кровообращения, печени, желудка, почек, при отравлениях, голодании, диабете, ожоговой болезни и т. п. может наблюдаться уменьшение или увеличение Ва но сравнению с нормой, т. е. патологические явления: ацидоз и алкалоз.
Ацидоз – это уменьшение кислотной буферной емкости физиологической системы по сравнению с нормой.
Алкалоз – это увеличение кислотной буферной емкости физиологической системы по сравнению с нормой.
Причинами ацидоза и алкалоза могут быть или увеличение содержания кислот, или уменьшение содержания буферных оснований в системе по сравнению с нормой.
Ацидоз или алкалоз могут быть экзогенного и эндогенного характера. Экзогенный ацидоз возникает при употреблении пищи с избыточным содержанием кислот (лимонной, бензойной, уксусной), а также лекарственных средств, трансформация которых в организме способствует понижению рН среды. Экзогенный алкалоз в основном возникает при поступлении в организм лекарств или других веществ, способствующих повышению рН среды, например, соды, ацетата калия. Эндогенный ацидоз или алкалоз возникает при нарушении протолитического баланса в организме вследствие нарушения соотношений скоростей синтеза и выведения тех или иных кислот или оснований.
В зависимости от глубины патологических изменений различают компенсированный и некомпенсированный ацидоз (алкалоз). При компенсированном ацидозе (алкалозе), несмотря на отклонение от нормы кислотной буферной емкости, рН крови сохраняет значение в пределах 7,35 < рН < 7,45. Некомпенсированный ацидоз сопровождается уменьшением кислотной буферной емкости и снижением рН крови (6,8 < рН < 7,35), а некомпенсированный алкалоз – увеличением кислотной буферной емкости и повышением рН крови (7,45 < рН < 7,9). Снижение рН крови по сравнению с нормой называется ацидемией, а повышение рН крови – алкалемией. Изменение значения рН крови на 0,6 единицы в любую сторону приводит к летальному исходу.
Для характеристики кислотно-основного состояния крови в физиологии и медицине используются следующие метаболические показатели: величина рН плазмы и цельной крови, парциальное напряжение (давление) углекислоты p(CO2), содержание гидрокарбоната в плазме крови, содержание буферных оснований в плазме крови ВВ, избыток или дефицит буферных оснований в крови BE. Величина рН плазмы крови– фактическая величина водородного показателя плазмы артериальной крови при 37 °С. Физиологические пределы – 7,35 < рН < 7,45.
Парциальное напряжение углекислоты р (СО2) –парциальное давление COg над кровью, находящейся в равновесии с растворенным в плазме СО2 при 37 °С. В физиологических условиях Р(СО2) = (40 ± 5) мм рт. ст. (5,3 кПа). Предельные значения парциального давления СО2 составляют при алкалозе 10 мм рт. ст., а при ацидозе – 130 мм рт. ст. Содержание гидрокарбоната в плазме крови в норме с (НСО3-)=(24,4 ± 3) ммоль/л. Содержание буферных оснований в плазме крови (ВВ) – нормальное значение для плазмы ВВ – (42 ± 3) ммоль/л. Избыток или дефицит буферных оснований в крови BE характеризует разницу между фактическим содержанием буферных оснований в крови у исследуемого человека и значением ВВ в  норме, равным 42 ммоль/л. В норме BE равен ±3 ммоль/л. При патологии интервал значений показателя BE значительно шире: ±30 ммоль/л.
норме, равным 42 ммоль/л. В норме BE равен ±3 ммоль/л. При патологии интервал значений показателя BE значительно шире: ±30 ммоль/л.
В клинической практике с помощью указанных метаболических показателей крови определяют наличие нарушений протолитического гомеостаза. Различают четыре вида первичных нарушений кислотно-основного баланса в организме, которые относятся к патологическим физиологическим процессам.
Метаболический ацидоз характеризуется избытком нелетучей кислоты или дефицитом гидрокарбонат-аниона в межклеточной жидкости. Показатели: Ва < норма; [донор протона] > норма; рН < норма; с(НСО3-) < норма; BE < норма; р(СО2) < норма.
Причины: нарушение кровообращения, кислородное голодание тканей, диарея (понос), нарушение выделительной функции почек, диабет.
Метаболический алкалоз характеризуется удалением молекул кислот или накоплением буферных оснований, включая содержание гидрокарбонат-аниона в межклеточной жидкости. Показатели: Ва > норма; [акцептор протона] > норма; рН > норма; с(НСО3-) > норма; BE > норма; р(СО2) > норма.
Причины: неукротимая рвота, удаление кислых продуктов из желудка, запор (накопление щелочных продуктов в кишечнике), длительный прием щелочной пищи и минеральной воды.
Респираторный (газовый) ацидоз характеризуется пониженной скоростью вентиляции легких по сравнению со скоростью образования метаболического СО2. Показатели: Ва< норма; [донор протона]>норма; рН < норма; c(HCO3-) > норма; BE > норма; p(СО2) > норма. Причины: заболевания органов дыхания, гиповентиляция легких, угнетение дыхательного центра некоторыми препаратами, например, барбитуратами.
Для проведения коррекции нарушений кислотно-основного состояния организма необходимо, прежде всего, выяснить причины их возникновения: нарушение процессов дыхания (респираторный ацидоз или алкалоз) или процессов пищеварения и выделения (метаболический ацидоз или алкалоз). Лечение респираторных нарушений требует всего нескольких дней, а для устранения метаболических нарушений обычно необходимы недели.
При ацидозе в качестве экстренной меры используют внутривенное вливание растворов гидрокарбоната натрия (по 100-200 мл 4,5 %-ного раствора, в острых случаях до 100 мл 8,4 %-ного раствора), но лучше вводить 3,66%-ный водный раствор трисамина H2NC(CH2OH)3 или 11 %-ный раствор лактата натрия. Последние средства, нейтрализуя кислоты, не выделяют СО2, что повышает их эффективность. Для устранения алкалоза иногда используют 5 %-ный раствор аскорбиновой кислоты, частично нейтрализованный гидрокарбонатом натрия до рН = 6,0-7,0.
В заключение следует отметить, что в живом организме вследствие процессов дыхания и пищеварения происходит постоянное образование двух противоположностей: кислот и оснований, причем, преимущественно слабых, что обеспечивает равновесный характер протолитическим процессам, протекающим в организме. В то же время из организма постоянно выводятся кислотно-основные продукты, в основном через легкие и почки. За счет сбалансированности процессов поступления и выведения кислот и оснований, а также за счет равновесного характера протолитических процессов, определяющих взаимодействие этих двух противоположностей, в организме поддерживается состояние протолитического (кислотно-основного) гомеостаза.
Методика выполнения вариантов заданий
На теоретические вопросы 1, 2 ответы подготовить по учебным пособиям и лекциям.
3. Напишите в ионной форме следующие уравнения:
AgNO3 + KI ® AgI↓ + KNO3;
Ag+ + NO3- + K+ + I- ® AgI↓ + K+ + NO3-;
Ag+ + I- ® AgI↓.
4. Написать уравнения гидролиза солей в молекулярном и ионном виде: аммоний сульфата; калий силиката.
· соль сульфат аммония (NH4)2SO4 образована слабым основанием и сильной кислотой. Гидролиз соли, образованной слабым основанием и сильной кислотой, сводится к гидролизу катиона слабого основания. В результате этого концентрация ионов Н+ в растворе становится больше концентрации ионов ОН- и раствор приобретает кислую реакцию (рН<7):
NH4+ + H2O ↔ NН4ОН + H+;
(NH4)2SO4 + 2Н2О ↔ 2NН4ОН+ H2SO4.
· соль силикат калия K2SiO3образована сильным основанием и слабой кислотой. Гидролиз соли, образованной сильным основанием и слабой кислотой, сводится к гидролизу аниона слабой кислоты. Поэтому в растворе соли K2SiО3 концентрация ионов ОН- становится больше концентрации ионов Н+, и реакция этого раствора щелочная (рН>7):
1) SiO32- + H2O ↔ HSiO3- + ОН-
K2SiO3+Н2О ↔ KНSiO3 + КОН;
2) HSiO3- + H2O ↔ H2SiO3 + ОН-
KHSiO3+Н2О ↔ Н2SiO3 + KОН.
5. Задача. Вычислить рН буферного раствора, состоящего из 80 мл 0,15 М
раствора CH3COOH и 20 мл 0,1 М раствора CH3COONa.
Константа электролитической диссоциации уксусной кислоты равна 1,85×10-5.
|
|
Дата добавления: 2014-11-29; Просмотров: 1616; Нарушение авторских прав?; Мы поможем в написании вашей работы!