
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Дидактические единицы. «Физико – химические основы восстановительной переработки железорудного и комплексного сырья»
|
|
|
|
Лекции №2
«Физико – химические основы восстановительной переработки железорудного и комплексного сырья»
План лекции:
1.Физико – химические основы восстановительной переработки железорудного и комплексного сырья.
2. Физико – химические основы сталеплавильных процессов и принцип их организации.
3. Характеристика процессов в основных сталеплавильных агрегатов.
4.Физико – химические основы электросталеплавильного и ферросплавных процессов.
5.Особенности протекания окислительно – восстановительных процессов в зависимости от распределения температуры соотношения жидких и твердых фаз.
Цель лекции
ознакомление с основами восстановытелъной переработкы рудного сыръя
Химические реакциы; диффузия; продукты химических реакций.
1. Учение о скоростях и механизме различных физико-механических процессов называется химической кинетикой. Скорости протекания химических реакций зависят от различных факторов- концентрации реагирующих веществ, давления, влияния интенсификаторов, катализаторов и др., а в случае гетерогенных превращений также от ряда других условий – состояния поверхности, условий тепло- и массообмена. В развитие учения о скоростях химических реакций и гетерогенных процессов большой вклад внесли работы Я. Вант-Гоффа, Н. А. Меншуткина, Н.А. Шилова, Н.Н. Семенова и др.
Тот факт, что химические реакции протекают с ускорением, имеет большое теоретические и прикладное значение. В черной и цветной металлургии в последние годы широко применяется кислород как интенсификатор металлургических процессов. Все большее значение для интенсификации технологических процессов приобретает температурный фактор.
2. В зависимости от того, в одной или нескольких фазах находятся компоненты реакции, различают кинетику гомогенных и гетерогенных химических реакций. Гомогенными называются такие химические реакции, в которых исходные вещества и продукты взаимодействия находятся в одной и той же фазе - газовой или жидкой, при этом молекулы, атомы, ионы взаимодействуют по всему занятому объему. Примером этого типа реакций могут служить реакции горения СО и Н2, входящих в состав конвертированного природного газа:
2СО+О2=2СО2; (1)
2Н2+О2=2Н2О. (2)
Гетерогенными называются такие химические реакции, когда участвующие в реакции вещества (включая и катализаторы) находятся в различных фазах, а сам процесс химического превращения протекает на границе раздела этих фаз. Примером гетерогенной химической реакции может служить реакция, протекающая в газовых регенераторах на поверхности раскаленных кусков твердого топлива:
С (углерод топлива) + О2 = СО2 (3)
СО2 + С(углерод топлива) = СО (4)

2С(углерод топлива) + О2 = 2СО (5)
К гетерогенным химическим реакциям относится реакция окисления углерода в ванне мартеновской печи. Схематически ее можно изобразить следующим образом:
(FеО) {CO}
↓ ↑
[Fe] + [C] = [Fe] + [CO]. (6)
Эта реакция происходит в три стадии:
1) диффузия кислорода (закиси железа) из шлака в металл;
2) химическая реакция между кислородом (закисью железа) углеродом в
металле;
3) выделение окиси углерода (продукт реакций) из металла.
3. Скорость сложной гетерогенной химической реакции определяется скоростью наиболее медленной стадии процесса. В рассматриваемой реакции (6) такой стадией является диффузия кислорода из шлака в металл.
Диффузией - называется процесс самопроизвольного выравнивания концентрации растворенного вещества, приводящий к установлению равномерного распределения концентраций в объеме раствора или расплава. Роль диффузии в кинетике гетерогенных процессов большая – чтобы процесс протекал с достаточной скоростью, продукты реакции должны удаляться с поверхности раздела фаз, что также происходит путем диффузии.
Движущей силой диффузии является градиент концентрации  , определяемой изменением концентрации растворенного вещества dc, приходящего на отрезок пути dx в направлении диффузии.
, определяемой изменением концентрации растворенного вещества dc, приходящего на отрезок пути dx в направлении диффузии.
Количество переносимого путем диффузии вещества dm прямо пропорционально градиенту концентрации, площади поперечного сечения S среды, через которую происходит диффузия и времени dτ. Тогда
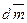 =
=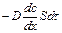 , (7)
, (7)
где D- коэффициент диффузии, а скорость диффузии
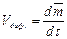 =
=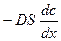 . (8)
. (8)
I-закон Фика: Скорость молекулярной диффузии прямо пропорциональна сечению системы и градиенту концентрации.
Уравнение (8) описывает стационарную диффузию и называется первым законом Фика. Знак минус в уравнении Фика указывает на то, что вещество перемещается в направлении уменьшения концентрации, т.е. 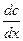 < 0.
< 0.
Размерность коэффициента диффузии 1 см2/сек. Коэффициент зависит от природы диффундирующего вещества и среды, в которой происходит диффузия, от температуры и в меньшей степени от концентрации и давления. Наибольшая скорость диффузии наблюдается:
─ в газах (D ≈ 1см2/сек);
─ в жидкостях (D ≈ 10-5см2/сек);
─ в твердых телах (D ~10-8 см2/сек).
Значения коэффициента атомарной диффузии в расправленном (неподвижным) железе при 1500-16000С составляют 10-4 -10-5 см2 /сек. При окислении углерода в мартеновских печах и возникающем в результате этого перемешивании скорость массопереноса резко увеличивается – коэффициент турбулентной диффузии в зависимости от скорости окисления углерода находится пределах 25-82 см2/сек. При кислородно-конвертерном процессе, отличающемся значительно более высокими скоростями окисления углерода по сравнению с мартеновским, а также тем, что перемешивание металла и шлака происходит не только за счет образования окиси углерода, но и за счет энергии кислородной струи, значения коэффициента турбулентной диффузии могут достигать 20 000-25 000 см2 /сек. Из приведенных данных следует, что скорость массопереноса внутри ванны кислородного конвертера в миллионы раз больше атомарной диффузии и в тысячи раз выше, чем в мартеновским печи.
4. Если определяющей стадией процесса химической реакции является само химическое воздействие, то это означает, что реакция протекает в кинетической области. Если же определяющей стадией процесса является подвод реагирующего вещества в зону реакции за счет диффузии, то считается, что реакция протекает диффузионной области. В тех случаях, когда скорости химической реакции и диффузии соизмеримы, процесс является сложной функцией кинетических и диффузионных явлений и протекает в переходной области.
Основной величиной в химической кинетике является скорость реакции, под которой понимают количество вещества, реагирующего за единицу времени в единице объема. Средняя скорость химической реакции может быть определена по формуле:
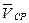 =
=  (9)
(9)
где с1 - концентрация вещества в начале реакции или в начале рассматриваемого отрезка времени;
с2 - концентрация вещества в конце реакции или в конце рассматриваемого отрезка времени;
τ - продолжительность химической реакции.
Истинная скорость реакции Vист представляет собой производную от концентрации ко времени:
Vист =  , (10)
, (10)
где dc - бесконечно малое изменение концентрации за бесконечное малое время d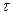 .
.
Различают реакции первого порядка (мономолекулярное), второго порядка (бимолекулярное) и т.д.
5. Реакцию первого порядка схематически можно представить следующем уравнением:
А → Продукт реакции. (11)
К числу таких реакций относится:
Н2→2Н; (12)
Н2О2→Н2О2+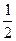 О2. (13)
О2. (13)
В соответствии с уравнением (11) и I законом действующих масс (I ЗДМ), скорость мономолекулярной реакции, или реакции первого порядка, выражается следующем образом:
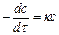 , (14)
, (14)
или
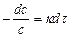 . (15)
. (15)
После интегрирования уравнения (15) в пределах концентраций от Со (начальная) до С (конечная) и времени от 0 до получим
 (16)
(16)
Уравнение (16) можно записать в таком виде:
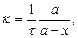
где а - начальная концентрация вещества;
х - изменение концентрации за время τ;
а - х - конечная концентрация вещества.
Реакции, константы скорости которых выражаются уравнениями (16) и (17), называются реакциями первого порядка.
Порядком называется показатель степени при концентрации в кинетическом уравнении скорости процесса:
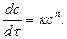
Реакцию второго порядка схематически можно представить следующим образом:
А + В → Продукт реакции. (18)
Скорость химической реакции второго порядка зависит от концентрации двух участвующих в реакции веществ.
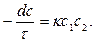 (19)
(19)
В том случае, если концентрации С1 и С2 неодинаковы, константы скорости реакции второго порядка можно определить по следующему уравнению:
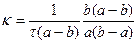 , (20)
, (20)
где а - начальная концентрация первого вещества;
b - начальная концентрация второго вещества;
х - уменьшение концентрации каждого вещества за время τ.
Если С1 = С2 (или а = b), то уравнение (19) принимает вид
 . (21)
. (21)
После интегрирование и соответствующей замены концентраций
 (22)
(22)
Реакции, константа скорости которых выражается уравнениями (21) и (22), называются реакция второго порядка.
Порядок реакции не всегда совпадает с ее молекулярностью. Для характеристики реакций первого порядка наряду с константой скорости часто пользуются периодом полураспада τ, равным времени, в течение которого реагирует половина взятого количества вещества.
Момент времени, отвечающей концу периода полураспада, можно определить из следующего уравнения:
 lnτ =
lnτ =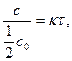 (23)
(23)
оттуда
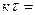 ln2
ln2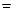 0,6932,
0,6932,
или
 (24)
(24)
Скорость реакции третьего порядка для трех разнородных молекул пропорциональна произведению концентрацию реагирующих веществ в данный момент времени:
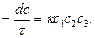 (25)
(25)
Если две или три молекулы однородны, это уравнение принимает следующий вид:
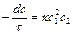 , (26)
, (26)
или  (27)
(27)
Примером реакции третьего порядка может быть реакция
2FeCl3+SnCl2→2FeCl2+SnCl4, (28)
Которая протекает в водном растворе. Уравнение скорости этой реакции можно записать так:
 (29)
(29)
где с1 - концентрация хлорного железа;
с2 - концентрация хлористого олова;
Вычислим константу скорости этой реакции. Пусть в объеме V до начала реакции было 2α молей хлористого олова и 2α молей хлористого железа. Через отрезок времени τ прореагировало α молей хлористого олова и 2α молей хлористого железа. Следовательно, концентрация в момент времени τ:
 с
с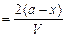 ; с
; с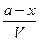 и
и 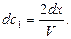
Подставим значения концентраций в уравнение скорости (29), тогда
 (30)
(30)
где 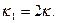
Разделим переменные, тогда
 (31)
(31)
После интегрирования уравнения, полагая, что если τ = 0, то х = 0, запишем
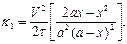 (32)
(32)
Из уравнения (32) следует, что константа скорости реакции третьего порядка зависит от квадрата объема системы.
Скорость химической реакции зависит от того, является ли она поверхностной (идущей на поверхности фаз), или объемной. Примером поверхностной реакции может служит реакция окисления марганца на границе металл - шлак.
[Mn] + (FeO) → (MnO) + [Fe], (33)
а примером объемной – раскисление стали алюминием
3[FeO] + 2[Al] → (Al2O3) + [Fe]. (34)
С повышением температуры скорость большинства реакций увеличивается. Зависимость константы скорости от температуры в области высоких температур выражается уравнением С. Аррениуса согласно правилу Аррениуса:
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 571; Нарушение авторских прав?; Мы поможем в написании вашей работы!