
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
План лекции. 1.Диаграммы состояния металлургических систем
|
|
|
|
1.Диаграммы состояния металлургических систем.
2.Кинетика и механизм процессов образования и диссоциации соединений. 3.Закономерности образования зародышей.
Цель лекции
Ознакомление с химической прочностью и дефектами кристаллических структур
Дидактические единицы:
Диссоциация химических соединений; горение углерода
1. Тепловые эффекты гетерогенных реакций горения зависит от кристаллического строения твердого углерода. Из его двух известных в природе модификаций, алмаза и графита, для процессов горения практический интерес представляет вторая.
Так называемый «аморфный» углерод, встречающийся в разновидностях твердого топлива, в действительности состоит из мелкодисперсных кристалликов, имеющих решетку графита. Эти формы углерода, при прочих равных условиях, различаются значениями энтальпии. При повышении температуры
Сал→ Сгр ∆Н=-15250 кДж/м.
ΔН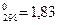 кДж/моль
кДж/моль
У крупно – кристаллического графита она меньше, чем у аморфного углерода, и последний сгорает с большим выделением тепла, чем графит.
Теплоты сгорания углерода каменноугольного кокса лежат м/у указанными тепловыми эффектами, т.к. кокс содержит и мелкодисперсные и сравнительно крупные кристаллы графита.
Поэтому нужно учитывать форму углерода, который претерпевает превращения в том или ином процессе.
2. При взаимодействии твердого углерода с газообразными окислителями, а именно с кислородом и водяным паром возможно одновременное протекания следующих пар реакций:
Неполное горение:
1. 
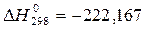 Кдж
Кдж
ΔG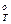 = –221120–180Т Дж/моль (1)
= –221120–180Т Дж/моль (1)
Полное горение:
2. С + О2 = СО2  Кдж
Кдж
ΔG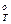 = –393260 – 2,3Т Дж/моль (2)
= –393260 – 2,3Т Дж/моль (2)
Обе реакции наблюдается при сжигании твердого топлива.
Газификация углерода
3. 2С + 2Н2О = 2СО + 2Н2  Кдж
Кдж
паром образование до СО:
ΔG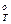 = 271080-288Т Дж/моль (3)
= 271080-288Т Дж/моль (3)
Газификация до СО2:
4. С + 2Н2О = СО2 + 2Н2 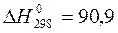 Кдж
Кдж
ΔG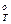 = 98960-1106Т Дж/моль (4)
= 98960-1106Т Дж/моль (4)
Экспериментальные данные ΔG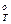 при Т = 0, 1000, 2000оС даны в таблице:
при Т = 0, 1000, 2000оС даны в таблице:
| Реакция | Температура | ||
| -221120 | -401120 | -581120 | |
| -393260 | -395560 | -397860 | |
| -16920 | -304920 | ||
| -11640 | -122240 |
Из анализа данных нормального сродства для реакции 1 и 2 следует, что они необратимы, т.е. идут практически до полного сгорания углерода в левой части равенства, так как реакции 1 и 2 имеют малую термодинамическую вероятность протекания в обратном направлении и во всем температурном интервале ΔG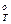 имеет отрицательные значения. Реакции 3 и 4 термодинамически вероятны как в прямом так и в обратном направлении. Это связано с различием знаков ΔН. В реакциях со свободным кислородом ΔН отрицательны (реакции горения), а в реакциях с водяным паром положительны. Вместе с тем изменение энтропии ΔS в реакциях 1, 3, 4 идущих с увеличением числа газовых молей положительно, а в реакции 2- слабо положительно. При сравнении реакций 3 и 4 видно, что до температуры пересечение более вероятно образования СО2 (2), а после пересечения – образование СО (1). Для реакций 6 и 7 зависимость аналогичная.
имеет отрицательные значения. Реакции 3 и 4 термодинамически вероятны как в прямом так и в обратном направлении. Это связано с различием знаков ΔН. В реакциях со свободным кислородом ΔН отрицательны (реакции горения), а в реакциях с водяным паром положительны. Вместе с тем изменение энтропии ΔS в реакциях 1, 3, 4 идущих с увеличением числа газовых молей положительно, а в реакции 2- слабо положительно. При сравнении реакций 3 и 4 видно, что до температуры пересечение более вероятно образования СО2 (2), а после пересечения – образование СО (1). Для реакций 6 и 7 зависимость аналогичная.
Характер изменения ΔG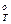 от температуры предопределяют температурные области преимущественного содержания в газовой фазе СО и СО2 в присутствии твердого углерода.
от температуры предопределяют температурные области преимущественного содержания в газовой фазе СО и СО2 в присутствии твердого углерода.
3. Что бы определить количественный состав и свойства газовой фазы в присутствии углерода удобно использовать суммарные реакции 1-2 и 3-4.
При алгебраическом суммировании с сокращением свободного кислорода получается реакция
1 → 2С + О2 = 2СО
2 → С + О2= СО2
5 → Ссг + СО2 ó 2СО
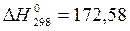 Кдж или 41,1 ккал
Кдж или 41,1 ккал
Реакция газификации углерода газом СО2 идет с поглощением тепла. Этот процесс развивается при горении углерода в слое и играет большую роль в шахтных печах. Обратный процесс экзотермический, где окись углерода разлагается с выделением сажистого углерода, наблюдаемых в восстановительных металлургических процессах.
При суммировании с сокращением углерода
1 → 2С + О2 = 2СО
2 → 2С + 2О2 = 2СО2
6 → 2СО + О2 = 2СО2
реакция догорания СО и
3 → 2С + 2Н2О = 2СО + 2Н2
4 → 2С + 4Н2О = 2СО2 + 2· 2Н2
7 → 2СО + 2Н2О = 2СО2 + 2Н2
или 8 → Н2 +СО2 = Н2О + СО (II) – реакция водяного газа.
Наиболее важным соотношением в газовой фазе с присутствиям углерода является отношения РСО / РСО2 определяемое реакцией газификации углерода 5.
Его можно определить из диаграмм равновесия этой реакции в координатах: состав газовой фазы СО - СО2 – температуры (РСО / РСО2 - параметр)
Резкое изменение равновесного состава газовой фазы от СО2 к СО происходит в интервале температур 500-900оС. При повышении давления в газовой фазе увеличивается содержание СО2, а при понижении давления – увеличивается содержание СО.
Реакция газификации углерода 5 имеют большое значение в доменном процессе и генераторным. Как видно она протекают слева направо с поглощением тепла и увеличением объема. При повышении температуры в равновесной газовой смеси увеличивается концентрация СО, а при повышении давления – концентрация СО2.
Система является двухкомпонентной и двухфазной. Поэтому С = К – Ф + 2 = 2 –2 + 2 = 2, следовательно равновесные концентрации СО и СО2 определяются двумя параметрами – температурой и давлениям. Равновесные условия этой реакции изучались в интервале температур 404-904оС при трех давлениях как со стороны СО2 (СО2 + С → 2СО), обратной так и со стороны
СО (2СО → СО2 + С) – прямой
В таблице приведены равновесный состав газовой фазы и значения Кр.
| Т, Со | Давления кПа | Характеристика равновесия при достижении со стороны | ||||||||||
| СО2 | СО | |||||||||||
| Состав газов. фазы, % |
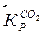
| Состав газов. фазы, % |

| |||||||||
| СО | СО2 | СО | СО2 | |||||||||
| 50,65 110,42 172,21 | 1,60 1,10 0,90 | 98,4 98,9 99,10 | 0,13∙10-3 0,133∙10-3 0,6∙10-2 | 1,70 1,20 0,90 | 98,30 98,80 99,10 | 0,147∙10-3 0,158∙10-3 0,139∙10-3 | ||||||
| 50,65 110,42 172,21 | 10,40 7,30 5,85 | 89,60 89,60 94,15 | 0,139∙10-3 0,626∙10-2 0,60∙10-2 | 10,50 7,25 6,0 | 89,50 92,75 94,0 | 0,61∙10-2 0,61∙10-2 0,65∙10-2 | ||||||
| 50,65 110,42 172,21 | 62,20 49,55 42,05 | 37,80 50,45 57,95 | 0,511 0,530 0,518 | 62,25 49,50 42,30 | 37,75 50,50 57,70 | 0,513 0,529 0,527 | ||||||
| 50,65 110,42 172,21 | 98,65 97,10 95,70 | 1,35 2,90 4,30 | 36,044 35,438 36,208 | 98,55 97,15 95,80 | 1,45 2,85 4,20 | 36,044 36,097 37,147 | ||||||
Константа равновесия рассчитывалась по уравнению:
Кр =  (5)
(5)
где Р – общее давления
ХСО – содержание СО при равновесии
Катализаторами реакции распада СО являются при низкой температуре железо, кобальт, никель, хром, алюминий, титан. Распад в ДП идет плохо.
Термодинамические характеристики состава и свойств газовой фазы можно определить величиной химического потенциала компонента μi измеренной относительно стандартные состояния μiо. Разность химических потенциалов кислорода (О2) в стандартном состоянии при Р = 101,3 кПа и при любом другом давлении (РО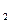 ) называется кислородным потенциалом
) называется кислородным потенциалом
П =Δμ = RTmPO2 (6)
При изотермическом переходе одного моля кислорода от Р = 101,3 кПа до РО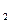 кислородный потенциал газовой фазы П0 (г.ф.) равен стандартному изменению изобарного потенциала:
кислородный потенциал газовой фазы П0 (г.ф.) равен стандартному изменению изобарного потенциала:
П0 = ΔG (7)
(7)
Для реакции 5 кислородный потенциал можно получить через давление кислороды или через отношение РСО2 / РСО
КР/3 =  (8)
(8)
логарифмируем это уравнение и умножаем на RT.
На основании этого уравнения можно построить график температурной зависимости кислородного потенциала для газовых смесей различного состава.
|
|
|
|
|
Дата добавления: 2014-01-05; Просмотров: 486; Нарушение авторских прав?; Мы поможем в написании вашей работы!